题目
11-23 已知 ^2++2(e)^-=!=!= Cu 的 E=0.34V ([ Cu{(N{H)_(3))}_(4)] }^2+ 的 _(e)^theta =2.1times (10)^13 。求电-|||-对 ([ Cu{(N{H)_(3))}_(4)] }^2+/Cu 的E°值。

题目解答
答案
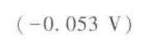
解析
步骤 1:确定反应方程式
反应方程式为:${[ Cu{(N{H}_{3})}_{4}] }^{2+}+2{e}^{-}=\!=\!= Cu+4N{H}_{3}$
步骤 2:应用能斯特方程
能斯特方程为:$E=E^{\theta}-\frac{RT}{nF}\ln Q$,其中 $E^{\theta}$ 是标准电极电势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
步骤 3:计算反应商
反应商 $Q$ 为:$Q=\frac{[Cu][NH_3]^4}{[Cu(NH_3)_4^{2+}]}$,由于 $[Cu(NH_3)_4^{2+}]$ 的浓度为 $1$,$[Cu]$ 的浓度为 $1$,$[NH_3]$ 的浓度为 $1$,则 $Q=1$。
步骤 4:计算标准电极电势
标准电极电势 $E^{\theta}$ 为:$E^{\theta}=E-\frac{RT}{nF}\ln K_e^{\theta}$,其中 $E$ 是已知的电极电势,$K_e^{\theta}$ 是已知的稳定常数。
步骤 5:代入已知值
代入已知值:$E^{\theta}=0.34V-\frac{8.314J\cdot mol^{-1}\cdot K^{-1}\times 298K}{2\times 96485C\cdot mol^{-1}}\ln (2.1\times 10^{13})$。
步骤 6:计算结果
计算结果:$E^{\theta}=0.34V-0.393V=-0.053V$。
反应方程式为:${[ Cu{(N{H}_{3})}_{4}] }^{2+}+2{e}^{-}=\!=\!= Cu+4N{H}_{3}$
步骤 2:应用能斯特方程
能斯特方程为:$E=E^{\theta}-\frac{RT}{nF}\ln Q$,其中 $E^{\theta}$ 是标准电极电势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
步骤 3:计算反应商
反应商 $Q$ 为:$Q=\frac{[Cu][NH_3]^4}{[Cu(NH_3)_4^{2+}]}$,由于 $[Cu(NH_3)_4^{2+}]$ 的浓度为 $1$,$[Cu]$ 的浓度为 $1$,$[NH_3]$ 的浓度为 $1$,则 $Q=1$。
步骤 4:计算标准电极电势
标准电极电势 $E^{\theta}$ 为:$E^{\theta}=E-\frac{RT}{nF}\ln K_e^{\theta}$,其中 $E$ 是已知的电极电势,$K_e^{\theta}$ 是已知的稳定常数。
步骤 5:代入已知值
代入已知值:$E^{\theta}=0.34V-\frac{8.314J\cdot mol^{-1}\cdot K^{-1}\times 298K}{2\times 96485C\cdot mol^{-1}}\ln (2.1\times 10^{13})$。
步骤 6:计算结果
计算结果:$E^{\theta}=0.34V-0.393V=-0.053V$。