题目
反应 (g)+2Y(g)=3Z(g) 在恒压和1000K时的 Delta (H)_(m) 为 cdot mo(L)^-1 Delta (S)_(m) 为-|||-] cdot mo(l)^-1cdot (K)^-1, 则下列关系中不正确的是 () 。-|||-(A) (Delta )_(r)(U)_(m)=(Delta )_(r)(H)_(m) (B) (Delta )_(r)(G)_(m)=0-|||-(C) (Delta )_(t)(U)_(m)=TDelta ({S)_(m)} (D) (Delta )_(r)(G)_(m)=(Delta )_(r)(H)_(m)

题目解答
答案
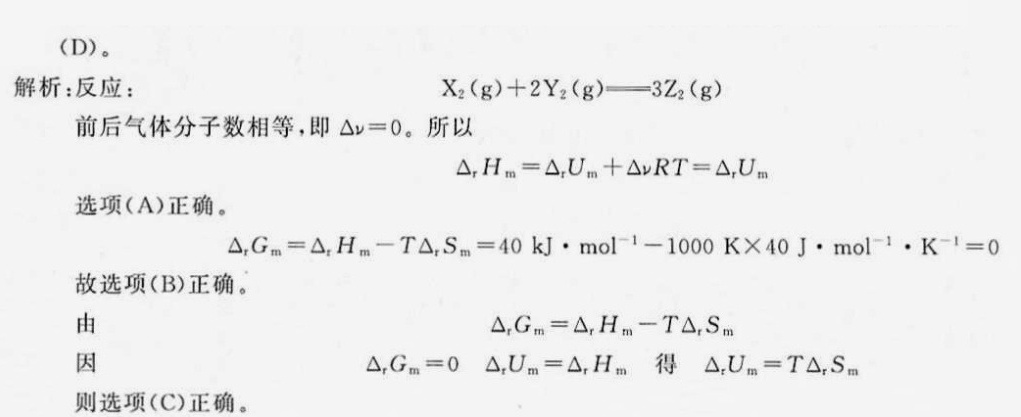
解析
本题考查化学反应热力学中的焓变(ΔH)、内能变(ΔU)、吉布斯自由能变(ΔG)的关系,以及反应方向的判断。关键点在于:
- 气体物质的量变化(Δn_gas)为0,导致ΔH = ΔU;
- ΔG = ΔH - TΔS的计算;
- 平衡条件下ΔG = 0与ΔH、ΔS的关系。
选项分析
选项(A) $\Delta _{i}U_{m} = \Delta _{r}H_{m}$
反应中气体物质的量变化 $\Delta n_{\text{gas}} = 3 - (1+2) = 0$,因此 $\Delta H = \Delta U$,选项正确。
选项(B) $\Delta _{r}G_{m} = 0$
根据 $\Delta G = \Delta H - T\Delta S$,代入 $\Delta H = 40 \, \text{kJ/mol}$,$\Delta S = 40 \, \text{J/mol·K} = 0.04 \, \text{kJ/mol·K}$,得:
$\Delta G = 40 - 1000 \times 0.04 = 0 \, \text{kJ/mol}$
选项正确。
选项(C) $\Delta _{r}U_{m} = T\Delta _{r}S_{m}$
因 $\Delta H = \Delta U$ 且 $\Delta H = T\Delta S$(当 $\Delta G = 0$ 时),故 $\Delta U = T\Delta S$,选项正确。
选项(D) $\Delta _{r}G_{m} = \Delta _{r}H_{m}$
由 $\Delta G = 0$ 而 $\Delta H = 40 \, \text{kJ/mol}$,显然 $\Delta G \neq \Delta H$,选项错误。