题目
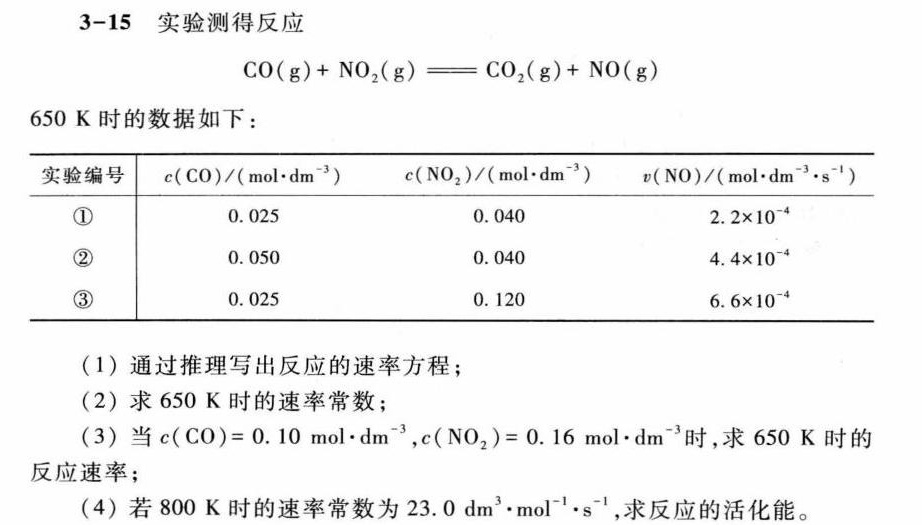
3-15 实验测得反应-|||-(g)+(N{O)_(2)}(g)=!=!= C(O)_(2)(g)+NO(g)-|||-650K时的数据如下:-|||-实验编号 (CO)ykparallel (molcdot (dm)^-3) . ((N{O)_(2)})/(molcdot (dm)^-3) (NO)/(molcdot (h)^-3cdot (s)^-1)-|||-① 0.025 0.040 .2times (10)^-4-|||-② 0.050 0.040 .4times (10)^-4-|||-③ 0.025 0.120 .6times (10)^-4-|||-(1)通过推理写出反应的速率方程;-|||-(2)求650K时的速率常数;-|||-(3)当 (CO)=0.10molcdot (dm)^-3 ((N{O)_(2)})=0.16molcdot (dm)^-3 时,求650K时的-|||-反应速率;-|||-(4)若800K时的速率常数为 .0(dm)^3cdot mo(l)^-1cdot (s)^-1, 求反应的活化能。
题目解答
答案

解析
步骤 1:确定反应的速率方程
对比实验①和实验②,$c(NO_2)$不变,$c(CO)$扩大2倍时,$v$扩大2倍。说明$v$与$c(CO)$成正比,即$v$对$CO$是一级反应。对比实验①和实验③,$c(CO)$不变,$c(NO_2)$扩大3倍时,$v$扩大3倍。说明$v$与$c(NO_2)$成正比,即$v$对$NO_2$是一级反应。故有 $v=kc(CO)c(NO_2)$。
步骤 2:求650K时的速率常数
将实验①的数据代入上述速率方程中,$k=\dfrac{v}{c(CO)\cdot c(NO_2)}$。代入实验①的数据,$k=\dfrac{2.2\times 10^{-4}mol\cdot dm^{-3}\cdot s^{-1}}{0.025mol\cdot dm^{-3}\times 0.040mol\cdot dm^{-3}}=0.22dm^3\cdot mol^{-1}\cdot s^{-1}$。
步骤 3:求650K时的反应速率
将题设数据代入速率方程,得 $v=kc(CO)c(NO_2)$。代入$c(CO)=0.10mol\cdot dm^{-3}$,$c(NO_2)=0.16mol\cdot dm^{-3}$,$v=0.22dm^3\cdot mol^{-1}\cdot s^{-1}\times 0.10mol\cdot dm^{-3}\times 0.16mol\cdot dm^{-3}=3.5\times 10^{-3}mol\cdot dm^{-3}\cdot s^{-1}$。
步骤 4:求反应的活化能
由公式 $\lg \dfrac{k_2}{k_1}=\dfrac{E_a}{2.303R}(\dfrac{T_2-T_1}{T_1T_2})$ 得 $E_a=\dfrac{2.303R T_2 T_1}{T_2-T_1}\lg \dfrac{k_2}{k_1}$。代入$k_1=0.22dm^3\cdot mol^{-1}\cdot s^{-1}$,$k_2=23.0dm^3\cdot mol^{-1}\cdot s^{-1}$,$T_1=650K$,$T_2=800K$,$E_a=1.3\times 10^2kJ\cdot mol^{-1}$。
对比实验①和实验②,$c(NO_2)$不变,$c(CO)$扩大2倍时,$v$扩大2倍。说明$v$与$c(CO)$成正比,即$v$对$CO$是一级反应。对比实验①和实验③,$c(CO)$不变,$c(NO_2)$扩大3倍时,$v$扩大3倍。说明$v$与$c(NO_2)$成正比,即$v$对$NO_2$是一级反应。故有 $v=kc(CO)c(NO_2)$。
步骤 2:求650K时的速率常数
将实验①的数据代入上述速率方程中,$k=\dfrac{v}{c(CO)\cdot c(NO_2)}$。代入实验①的数据,$k=\dfrac{2.2\times 10^{-4}mol\cdot dm^{-3}\cdot s^{-1}}{0.025mol\cdot dm^{-3}\times 0.040mol\cdot dm^{-3}}=0.22dm^3\cdot mol^{-1}\cdot s^{-1}$。
步骤 3:求650K时的反应速率
将题设数据代入速率方程,得 $v=kc(CO)c(NO_2)$。代入$c(CO)=0.10mol\cdot dm^{-3}$,$c(NO_2)=0.16mol\cdot dm^{-3}$,$v=0.22dm^3\cdot mol^{-1}\cdot s^{-1}\times 0.10mol\cdot dm^{-3}\times 0.16mol\cdot dm^{-3}=3.5\times 10^{-3}mol\cdot dm^{-3}\cdot s^{-1}$。
步骤 4:求反应的活化能
由公式 $\lg \dfrac{k_2}{k_1}=\dfrac{E_a}{2.303R}(\dfrac{T_2-T_1}{T_1T_2})$ 得 $E_a=\dfrac{2.303R T_2 T_1}{T_2-T_1}\lg \dfrac{k_2}{k_1}$。代入$k_1=0.22dm^3\cdot mol^{-1}\cdot s^{-1}$,$k_2=23.0dm^3\cdot mol^{-1}\cdot s^{-1}$,$T_1=650K$,$T_2=800K$,$E_a=1.3\times 10^2kJ\cdot mol^{-1}$。