题目
5.已知 _(2)(g)+C(O)_(2)(g)=(H)_(2)O(g)+CO(g) 的平衡常数为 _(1) ,_(2)(g)+dfrac (1)(2)(O)_(2)(g)=-|||-H2O(g)的平衡常数为K2。在同温度下的反应 (O)_(2)(g)=CO(g)+dfrac (1)(2)(O)_(2)(g) 的 _(3) 等于-|||-() 。-|||-A.K1·K2 B. _(1)^theta +(K)_(2)^theta C. _(1)^theta /({K)_(2)}^theta D. _(2)/(K)_(1)^theta

题目解答
答案
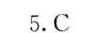
解析
本题考查化学平衡常数的运算规则。关键思路是通过已知的两个反应式推导出目标反应式,并利用平衡常数的乘除关系求解。破题点在于将目标反应视为反应1与反应2的差运算,从而确定平衡常数的关系。
反应关系推导
- 反应1:
$\text{H}_2(g) + \text{CO}_2(g) \rightleftharpoons \text{H}_2\text{O}(g) + \text{CO}(g) \quad K_1 = \frac{[\text{H}_2\text{O}][\text{CO}]}{[\text{H}_2][\text{CO}_2]}$ - 反应2:
$\text{H}_2(g) + \frac{1}{2}\text{O}_2(g) \rightleftharpoons \text{H}_2\text{O}(g) \quad K_2 = \frac{[\text{H}_2\text{O}]}{[\text{H}_2][\text{O}_2]^{1/2}}$ - 目标反应:
$\text{CO}_2(g) \rightleftharpoons \text{CO}(g) + \frac{1}{2}\text{O}_2(g) \quad K_3 = ?$
关键步骤
- 反应组合:将反应1减去反应2,消去$\text{H}_2$和$\text{H}_2\text{O}$,得到目标反应。
- 平衡常数运算:根据平衡常数的差运算规则,$K_3 = \frac{K_1}{K_2}$。