题目
如图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol•L-1)];c(M)≤10-5mol•L-1可认为M离子沉淀完全)。下列叙述正确的是( )6 (e)^3+ +-|||-5-|||-4-|||-3-|||-a -|||-2-|||-1-|||-1 2 3 4 5 6 7-|||-^2+A. 由a点可求得Ksp[Fe(OH)3]=10-8.5B. pH=4时Al(OH)3的溶解度为(({{10)^-10}})/(3)mol•L-1C. 浓度均为0.01mol•L-1的Al3+和Fe3+可通过分步沉淀进行分离D. Al3+、Cu2+混合溶液中c(Cu2+)=0.2mol•L-1时二者不会同时沉淀
如图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图{pM=-lg[c(M)/(mol•L-1)];c(M)≤10-5mol•L-1可认为M离子沉淀完全}。下列叙述正确的是( )
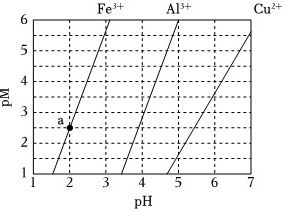

- A. 由a点可求得Ksp[Fe(OH)3]=10-8.5
- B. pH=4时Al(OH)3的溶解度为$\frac{{{{10}^{-10}}}}{3}$mol•L-1
- C. 浓度均为0.01mol•L-1的Al3+和Fe3+可通过分步沉淀进行分离
- D. Al3+、Cu2+混合溶液中c(Cu2+)=0.2mol•L-1时二者不会同时沉淀
题目解答
答案
A.由图可知,a点pH=2,c(H+)=10-2mol/L,c(OH-)=10-12mol/L,c(Fe3+)=10-2.5mol/L,所以Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=10-38.5,故A错误;
B.根据图象Al3+的曲线,Ksp[Al(OH)3]=10-33,pH=4时,c(H+)=10-4mol/L,c(OH-)=10-10mol/L,c(Al3+)=$\frac{{K}_{sp}[Al(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{1{0}^{-33}}{(1{0}^{-10})^{3}}$mol/L=10-3mol/L,即Al(OH)3的溶解度为10-3mol/L,故B错误;
C.由图象可知,Fe3+优先沉淀,当Fe3+沉淀完全时,c3(OH-)=$\frac{1{0}^{-38.5}}{1{0}^{-5}}$(mol/L)3=10-33.5(mol/L)3,此时Qsp[Al(OH)3]=0.01mol/L×10-33.5(mol/L)3=10-35.5(mol/L)3<Ksp[Al(OH)3]=10-33,Al3+还未沉淀,所以浓度均为0.01mol•L-1的Al3+和Fe3+可通过分步沉淀进行分离,故C正确;
D.根据图象Cu2+的曲线,pH=7时,c(H+)=10-7mol/L,c(OH-)=10-7mol/L,c(Cu2+)=10-5.5mol/L,Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=10-5.5(10-7)2=10-19.5,由B分析知Ksp[Al(OH)3]=10-33,Al3+沉淀完全时的c(OH-)=$(\frac{1{0}^{-33}}{1{0}^{-5}})^{\frac{1}{3}}$mol/L≈10-9.3mol/L,c(H+)≈10-4.7mol/L,pH=4.7,此时Cu2+刚开始沉淀,c(Cu2+)=0.1mol/L,若c(Cu2+)=0.2mol•L-1>0.1mol•L-1,因此Al3+、Cu2+会同时沉淀,故D错误;
故选:C。
B.根据图象Al3+的曲线,Ksp[Al(OH)3]=10-33,pH=4时,c(H+)=10-4mol/L,c(OH-)=10-10mol/L,c(Al3+)=$\frac{{K}_{sp}[Al(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{1{0}^{-33}}{(1{0}^{-10})^{3}}$mol/L=10-3mol/L,即Al(OH)3的溶解度为10-3mol/L,故B错误;
C.由图象可知,Fe3+优先沉淀,当Fe3+沉淀完全时,c3(OH-)=$\frac{1{0}^{-38.5}}{1{0}^{-5}}$(mol/L)3=10-33.5(mol/L)3,此时Qsp[Al(OH)3]=0.01mol/L×10-33.5(mol/L)3=10-35.5(mol/L)3<Ksp[Al(OH)3]=10-33,Al3+还未沉淀,所以浓度均为0.01mol•L-1的Al3+和Fe3+可通过分步沉淀进行分离,故C正确;
D.根据图象Cu2+的曲线,pH=7时,c(H+)=10-7mol/L,c(OH-)=10-7mol/L,c(Cu2+)=10-5.5mol/L,Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=10-5.5(10-7)2=10-19.5,由B分析知Ksp[Al(OH)3]=10-33,Al3+沉淀完全时的c(OH-)=$(\frac{1{0}^{-33}}{1{0}^{-5}})^{\frac{1}{3}}$mol/L≈10-9.3mol/L,c(H+)≈10-4.7mol/L,pH=4.7,此时Cu2+刚开始沉淀,c(Cu2+)=0.1mol/L,若c(Cu2+)=0.2mol•L-1>0.1mol•L-1,因此Al3+、Cu2+会同时沉淀,故D错误;
故选:C。
解析
本题考查金属氢氧化物的沉淀溶解平衡,涉及溶度积($K_{sp}$)的计算、分步沉淀的条件判断及溶解度的计算。解题关键在于:
- 理解pM-pH图的含义:pM=-lg[c(M)],c(M)=10^{-pM};当c(M)≤10^{-5} mol/L时,离子沉淀完全。
- 溶度积的计算:$K_{sp}=c(\text{金属离子}) \cdot c(\text{OH}^-)^{\text{价态}}$。
- 分步沉淀的条件:通过调节pH使不同金属离子分阶段沉淀,需保证先沉淀的金属离子完全沉淀时,后续金属离子的溶度积商($Q_{sp}$)小于其$K_{sp}$。
- 同时沉淀的判断:比较溶液中离子浓度与溶度积的关系。
选项A
- 关键点:a点pH=2,对应c(Fe³+)=10^{-3.5} mol/L,c(OH⁻)=10^{-12} mol/L。
- 计算:
$K_{sp}[\text{Fe(OH)}_3] = c(\text{Fe}^{3+}) \cdot c(\text{OH}^-)^3 = 10^{-3.5} \cdot (10^{-12})^3 = 10^{-39.5}$
选项A给出$10^{-8.5}$,错误。
选项B
- 关键点:pH=4时,c(OH⁻)=10^{-10} mol/L,$K_{sp}[\text{Al(OH)}_3]=10^{-33}$。
- 计算:
$c(\text{Al}^{3+}) = \frac{K_{sp}[\text{Al(OH)}_3]}{c(\text{OH}^-)^3} = \frac{10^{-33}}{(10^{-10})^3} = 10^{-3} \, \text{mol/L}$
溶解度为$10^{-3}$ mol/L,选项B错误。
选项C
- 关键点:Fe³+优先沉淀,当Fe³+沉淀完全(c(Fe³+)=10^{-5} mol/L)时,计算此时$Q_{sp}[\text{Al(OH)}_3]$。
- 计算:
$c(\text{OH}^-) = \left( \frac{K_{sp}[\text{Fe(OH)}_3]}{c(\text{Fe}^{3+})} \right)^{1/3} = \left( \frac{10^{-39.5}}{10^{-5}} \right)^{1/3} = 10^{-11.5} \, \text{mol/L}$
$Q_{sp}[\text{Al(OH)}_3] = c(\text{Al}^{3+}) \cdot c(\text{OH}^-)^3 = 0.01 \cdot (10^{-11.5})^3 = 10^{-35.5} < K_{sp}[\text{Al(OH)}_3] = 10^{-33}$
Al³+未沉淀,可分步分离,选项C正确。
选项D
- 关键点:计算Cu²+开始沉淀时的c(OH⁻)及对应pH,判断此时Al³+是否沉淀。
- 计算:
$K_{sp}[\text{Cu(OH)}_2] = c(\text{Cu}^{2+}) \cdot c(\text{OH}^-)^2 = 10^{-5.5} \cdot (10^{-7})^2 = 10^{-19.5}$
当c(Cu²+)=0.2 mol/L时,
$c(\text{OH}^-) = \sqrt{\frac{K_{sp}[\text{Cu(OH)}_2]}{c(\text{Cu}^{2+})}} = \sqrt{\frac{10^{-19.5}}{0.2}} \approx 10^{-9.3} \, \text{mol/L}$
此时c(Al³+)=10^{-5} mol/L < 0.2 mol/L,Al³+未完全沉淀,两者会同时沉淀,选项D错误。