题目
已知将反应(varphi )^theta ((Ag)^+/Ag)=0.80V , (varphi )^theta ((Fe)^3+/(Fe)^2+)=0.77V Ag++Fe2+=Ag+Fe3+设计成原电池。 (1)计算标准状态下原电池的电动势Etheta;和平衡常数Ktheta;。 (2)若只改变Fe2+的浓度,使c(Fe2+)=0.001molL-1,而其他条件不变,计算电池的电动势,说明反应自发进行的方向。
已知将反应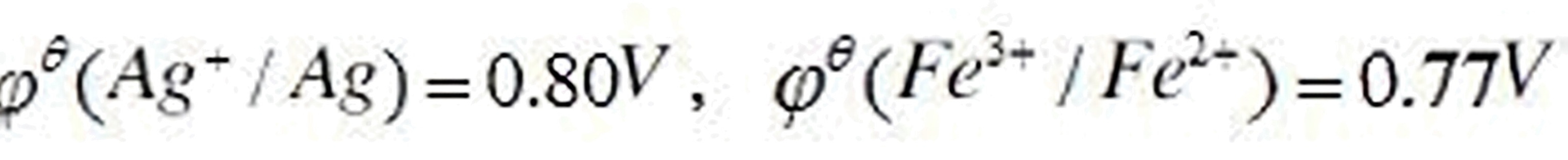 Ag++Fe2+=Ag+Fe3+设计成原电池。 (1)计算标准状态下原电池的电动势Etheta;和平衡常数Ktheta;。 (2)若只改变Fe2+的浓度,使c(Fe2+)=0.001molL-1,而其他条件不变,计算电池的电动势,说明反应自发进行的方向。
Ag++Fe2+=Ag+Fe3+设计成原电池。 (1)计算标准状态下原电池的电动势Etheta;和平衡常数Ktheta;。 (2)若只改变Fe2+的浓度,使c(Fe2+)=0.001molL-1,而其他条件不变,计算电池的电动势,说明反应自发进行的方向。
题目解答
答案

解析
本题考查电化学中原电池电动势、平衡常数的计算以及浓度改变对电动势的影响和反应自发方向的判断。解题思路如下:
(1)计算标准状态下原电池的电动势 $E^{\theta}$ 和平衡常数 $K^{\theta}$
- 确定正负极:根据标准电极电势,$\varphi^{\theta}(Ag^{+}/Ag) > \varphi^{\theta}(Fe^{3+}/Fe^{2+})$,所以 $Ag^{+}/Ag$ 电对为正极,$Fe^{3+}/Fe^{2+}$ 电对为负极。
- 计算原电池电动势 $E^{\theta}$:原电池电动势 $E^{\theta}$ 等于正极电极电势减去负极电极电势,即 $E^{\theta}=\varphi^{\theta}(Ag^{+}/Ag)-\varphi^{\theta}(Fe^{3+}/Fe^{2+})$。
- 代入数据可得 $E^{\theta}=0.80V - 0.77V = 0.03V$。
- 计算平衡常数 $K^{\theta}$:根据能斯特方程的推导,$\lg K^{\theta}=\frac{nE^{\theta}}{0.059}$,其中 $n$ 为反应转移的电子数,本题反应转移电子数 $n = 1$。
- 代入 $n = 1$,$E^{\theta}=0.03V$ 可得 $\lg K^{\theta}=\frac{1\times 0.03V}{0.059V}=0.508$。
- 则 $K^{\theta}=10^{0.508}=0.310$。
(2)若只改变 $Fe^{2+}$ 的浓度,使 $c(Fe^{2+}) = 0.001mol\cdot L^{-1}$,而其他条件不变,计算电池的电动势,说明反应自发进行的方向
- 根据能斯特方程计算电池电动势 $E$:能斯特方程表达式为 $E = E^{\theta}-\frac{0.059}{n}\lg\frac{c(氧化态)}{c(还原态)}$。
- 对于本题反应 $Ag^{+}+Fe^{2+}=Ag + Fe^{3+}$,$n = 1$,$E^{\theta}=0.03V$,$c(Fe^{2+}) = 0.001mol\cdot L^{-1}$,假设 $c(Ag^{+}) = 1mol\cdot L^{-1}$,$c(Fe^{3+}) = 1mol\cdot L^{-1}$,$c(Ag) = 1mol\cdot L^{-1}$。
- 代入能斯特方程可得 $E = 0.03V-\frac{0.059}{1}\lg\frac{1\times 1}{0.001\times 1}=0.03V - 0.059V\times 3 = 0.03V - 0.177V=-0.147V$。
- 判断反应自发进行的方向:根据吉布斯自由能与电动势的关系 $\Delta G=-nFE$,当 $E < 0$ 时,$\Delta G > 0$,反应逆向自发。