题目
配合物Na3[Co(NO2)6](M=404g•mol-1)在分析化学中用于K+的鉴定,其制备装置示意图(夹持装置等略)及步骤如图:a-|||-b-|||-磁力搅拌器①向三颈烧瓶中加入15.0gNaNO2和15.0mL热蒸馏水,搅拌溶解。②磁力搅拌下加入5.0gCo(NO3)2•6H2O,从仪器a加入50%醋酸7.0mL。冷却至室温后,再从仪器b缓慢滴入30%双氧水8.0mL。待反应结束,滤去固体。③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。已知:i.乙醇、乙醚的沸点分别是78.5℃、34.5℃;ii.NaNO2的溶解度数据如下表。 温度/℃ 20 30 40 50 溶解度/(g/100gH2O) 84.5 91.6 98.4 104.1 回答下列问题:(1)仪器a的名称是 ____ ,使用前应 ____ 。(2)Na3[Co(NO2)6]中钴的化合价是 ____ ,制备该配合物的化学方程式为 ____ 。(3)步骤①中,用热蒸馏水的目的是 ____ 。(4)步骤③中,用乙醚洗涤固体产品的作用是 ____ 。(5)已知:2K++Na++[Co(NO2)6]3-(underline(中性或弱酸性))/(;)K2Na[Co(NO2)6]↓(亮黄色)足量KCl与1.010g产品反应生成0.872g亮黄色沉淀,产品纯度为 ____ %。(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧, ____ 。
配合物Na3[Co(NO2)6](M=404g•mol-1)在分析化学中用于K+的鉴定,其制备装置示意图(夹持装置等略)及步骤如图:
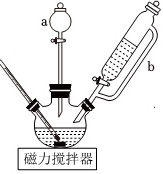
①向三颈烧瓶中加入15.0gNaNO2和15.0mL热蒸馏水,搅拌溶解。
②磁力搅拌下加入5.0gCo(NO3)2•6H2O,从仪器a加入50%醋酸7.0mL。冷却至室温后,再从仪器b缓慢滴入30%双氧水8.0mL。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是78.5℃、34.5℃;
ii.NaNO2的溶解度数据如下表。
回答下列问题:
(1)仪器a的名称是 ____ ,使用前应 ____ 。
(2)Na3[Co(NO2)6]中钴的化合价是 ____ ,制备该配合物的化学方程式为 ____ 。
(3)步骤①中,用热蒸馏水的目的是 ____ 。
(4)步骤③中,用乙醚洗涤固体产品的作用是 ____ 。
(5)已知:2K++Na++[Co(NO2)6]3-$\frac{\underline{中性或弱酸性}}{\;}$K2Na[Co(NO2)6]↓(亮黄色)足量KCl与1.010g产品反应生成0.872g亮黄色沉淀,产品纯度为 ____ %。
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧, ____ 。

①向三颈烧瓶中加入15.0gNaNO2和15.0mL热蒸馏水,搅拌溶解。
②磁力搅拌下加入5.0gCo(NO3)2•6H2O,从仪器a加入50%醋酸7.0mL。冷却至室温后,再从仪器b缓慢滴入30%双氧水8.0mL。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是78.5℃、34.5℃;
ii.NaNO2的溶解度数据如下表。
| 温度/℃ | 20 | 30 | 40 | 50 |
| 溶解度/(g/100gH2O) | 84.5 | 91.6 | 98.4 | 104.1 |
(1)仪器a的名称是 ____ ,使用前应 ____ 。
(2)Na3[Co(NO2)6]中钴的化合价是 ____ ,制备该配合物的化学方程式为 ____ 。
(3)步骤①中,用热蒸馏水的目的是 ____ 。
(4)步骤③中,用乙醚洗涤固体产品的作用是 ____ 。
(5)已知:2K++Na++[Co(NO2)6]3-$\frac{\underline{中性或弱酸性}}{\;}$K2Na[Co(NO2)6]↓(亮黄色)足量KCl与1.010g产品反应生成0.872g亮黄色沉淀,产品纯度为 ____ %。
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧, ____ 。
题目解答
答案
解:(1)仪器a的名称是分液漏斗,使用前应检漏,
故答案为:分液漏斗;检漏;
(2)Na3[Co(NO2)6]中钠是+1价亚硝酸根是-1价,根据化合价代数和为0,钴的化合价是+3,制备该配合物的化学方程式为12NaNO2+2Co(NO3)2+H2O2+2CH3COOH=2Na3[Co(NO2)6]+4NaNO3+2CH3COONa+2H2O,
故答案为:+3;12NaNO2+2Co(NO3)2+H2O2+2CH3COOH=2Na3[Co(NO2)6]+4NaNO3+2CH3COONa+2H2O;
(3)步骤①中,用热蒸馏水的目的是增加NaNO2的溶解度,
故答案为:增加NaNO2的溶解度;
(4)步骤③中,用乙醚洗涤固体产品的作用是加速产品干燥,
故答案为:加速产品干燥;
(5)已知:$2{K}^{+}+N{a}^{+}+{[Co{(N{O}_{2})}_{6}]}^{3-}\frac{\underline{中性或弱酸性}}{\;}{K}_{2}Na[Co{(N{O}_{2})}_{6}]↓$(亮黄色)足量KCl与1.010g产品反应生成0.872g亮黄色沉淀,则$n({K}_{2}Na[Co{(N{O}_{2})}_{6}])=n(N{a}_{3}[Co{(N{O}_{2})}_{6}])=\frac{0.872}{436}mol=0.002mol$,m(Na3[Co(NO2)6])=0.002mol×404g/mol=0.808g,产品纯度为$\frac{0.808}{1.010}×100%=80%$,
故答案为:80.0;
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色,若呈紫色则含钾元素,
故答案为:透过蓝色钴玻璃观察火焰的颜色,若呈紫色则含钾元素。
故答案为:分液漏斗;检漏;
(2)Na3[Co(NO2)6]中钠是+1价亚硝酸根是-1价,根据化合价代数和为0,钴的化合价是+3,制备该配合物的化学方程式为12NaNO2+2Co(NO3)2+H2O2+2CH3COOH=2Na3[Co(NO2)6]+4NaNO3+2CH3COONa+2H2O,
故答案为:+3;12NaNO2+2Co(NO3)2+H2O2+2CH3COOH=2Na3[Co(NO2)6]+4NaNO3+2CH3COONa+2H2O;
(3)步骤①中,用热蒸馏水的目的是增加NaNO2的溶解度,
故答案为:增加NaNO2的溶解度;
(4)步骤③中,用乙醚洗涤固体产品的作用是加速产品干燥,
故答案为:加速产品干燥;
(5)已知:$2{K}^{+}+N{a}^{+}+{[Co{(N{O}_{2})}_{6}]}^{3-}\frac{\underline{中性或弱酸性}}{\;}{K}_{2}Na[Co{(N{O}_{2})}_{6}]↓$(亮黄色)足量KCl与1.010g产品反应生成0.872g亮黄色沉淀,则$n({K}_{2}Na[Co{(N{O}_{2})}_{6}])=n(N{a}_{3}[Co{(N{O}_{2})}_{6}])=\frac{0.872}{436}mol=0.002mol$,m(Na3[Co(NO2)6])=0.002mol×404g/mol=0.808g,产品纯度为$\frac{0.808}{1.010}×100%=80%$,
故答案为:80.0;
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色,若呈紫色则含钾元素,
故答案为:透过蓝色钴玻璃观察火焰的颜色,若呈紫色则含钾元素。