题目
电导率是衡量物质导电能力大小的物理量,将NaOH稀溶液滴加到稀盐酸过程中电导率曲线如图所示。下列说法不正确的是电导率↑a-|||-b-|||-d-|||-c-|||-O V(N aOH溶液) A.b点反应的离子方程式为H++OH-=H2OB.把NaOH稀溶液换成NaOH浓溶液,电导率曲线不变C.溶液的酸性:a>b>c>d D.c点溶液呈中性
电导率是衡量物质导电能力大小的物理量,将NaOH稀溶液滴加到稀盐酸过程中电导率曲线如图所示。下列说法不正确的是
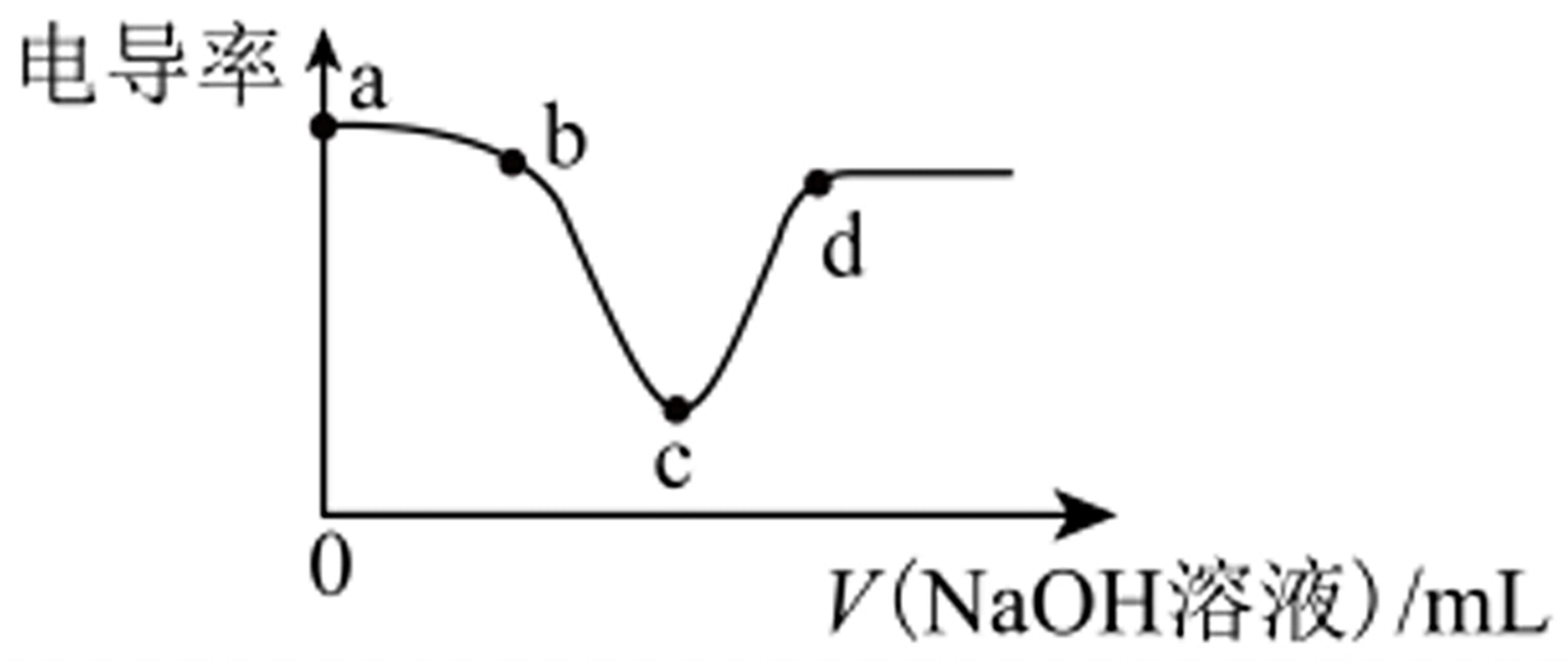

| A.b点反应的离子方程式为H++OH-=H2O |
| B.把NaOH稀溶液换成NaOH浓溶液,电导率曲线不变 |
| C.溶液的酸性:a>b>c>d |
| D.c点溶液呈中性 |
题目解答
答案

解析
步骤 1:理解电导率曲线
电导率曲线显示了随着NaOH溶液滴加到稀盐酸中,溶液的导电能力的变化。电导率的增加表明溶液中离子浓度的增加,而电导率的减少则表明离子浓度的减少。
步骤 2:分析各点的性质
- a点:盐酸溶液,酸性较强,电导率较高。
- b点:盐酸和NaOH开始反应,生成水和NaCl,电导率开始下降。
- c点:盐酸和NaOH完全反应,生成水和NaCl,电导率最低,因为此时溶液中主要是NaCl,NaCl的电导率低于盐酸。
- d点:NaOH过量,电导率再次上升,因为NaOH的加入增加了溶液中的离子浓度。
步骤 3:分析选项
A.b点反应的离子方程式为H++OH-=H2O,正确。
B.把NaOH稀溶液换成NaOH浓溶液,电导率曲线会变化,因为NaOH浓溶液的加入会立即增加溶液的电导率,正确。
C.溶液的酸性:a>b>c>d,正确。
D.c点溶液呈中性,正确。
电导率曲线显示了随着NaOH溶液滴加到稀盐酸中,溶液的导电能力的变化。电导率的增加表明溶液中离子浓度的增加,而电导率的减少则表明离子浓度的减少。
步骤 2:分析各点的性质
- a点:盐酸溶液,酸性较强,电导率较高。
- b点:盐酸和NaOH开始反应,生成水和NaCl,电导率开始下降。
- c点:盐酸和NaOH完全反应,生成水和NaCl,电导率最低,因为此时溶液中主要是NaCl,NaCl的电导率低于盐酸。
- d点:NaOH过量,电导率再次上升,因为NaOH的加入增加了溶液中的离子浓度。
步骤 3:分析选项
A.b点反应的离子方程式为H++OH-=H2O,正确。
B.把NaOH稀溶液换成NaOH浓溶液,电导率曲线会变化,因为NaOH浓溶液的加入会立即增加溶液的电导率,正确。
C.溶液的酸性:a>b>c>d,正确。
D.c点溶液呈中性,正确。