题目
((H)^-)/molcdot (L)^-1-|||--6 B-|||--7=7 A-|||-0 10^(-1)0^(-6)-|||-c(H^+)/rool·L^(-1)按要求回答下列问题:(1)常温下,有关下列四种溶液的说法正确的是 ____ 。 ① ② ③ ④ 0.1mol•L-1氨水 pH=11氨水 0.1mol•L-1盐酸 pH=3盐酸 A.由水电离出的c(H+):③>①B.①稀释到原来的100倍,pH与②相同C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>c(Cl-)D.②与④等体积混合,混合溶液的pH>7(2)已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol•L-1,溶液中的c(OH-)= ____ mol•L-1。将SO2通入该氨水中,当c(OH−)降至1.0×10-7mol•L-1时,溶液中的(c(S(O)_(3)^2-))/(c(HS(O)_{3)^-)}= ____ 。(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。①曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1 ____ α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH ____ 7。②在曲线B所对应的温度下,将0.02mol•L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH= ____ 。③若另一温度下测得0.01mol•L-1的NaOH溶液的pH为11。在该温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。若所得混合液的pH=10,且a=12,b=2,则Va:Vb= ____ 。(4)在25℃下,将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb= ____ 。
 按要求回答下列问题:
按要求回答下列问题:(1)常温下,有关下列四种溶液的说法正确的是 ____ 。
| ① | ② | ③ | ④ |
| 0.1mol•L-1氨水 | pH=11氨水 | 0.1mol•L-1盐酸 | pH=3盐酸 |
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>c(Cl-)
D.②与④等体积混合,混合溶液的pH>7
(2)已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol•L-1,溶液中的c(OH-)= ____ mol•L-1。将SO2通入该氨水中,当c(OH−)降至1.0×10-7mol•L-1时,溶液中的$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$= ____ 。
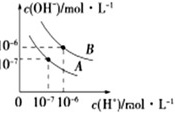
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。
①曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1 ____ α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH ____ 7。
②在曲线B所对应的温度下,将0.02mol•L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH= ____ 。
③若另一温度下测得0.01mol•L-1的NaOH溶液的pH为11。在该温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。若所得混合液的pH=10,且a=12,b=2,则Va:Vb= ____ 。
(4)在25℃下,将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数Kb= ____ 。
题目解答
答案
解:(1)A.0.1mol/LHCl溶液中,由水电离出的c(H+)等于溶液中c(OH-),为$\frac{10{}^{-14}}{0.1}$mol/L=10-13mol/L,一水合氨是弱碱,0.1mol/L氨水中c(OH-)<0.1mol/L,则由水电离出的c(H+)大于溶液中c(H+)=$\frac{10{}^{-14}}{0.1}$mol/L=10-13mol/L,则由水电离出的c(H+):①>③,故A错误;
B.0.1mol/L氨水中c(OH-)<0.1mol/L,溶液的pH<13,稀释到原来的100倍时促进氨水电离,pH变化小于2个单位,则①的pH与②不同,故B错误;
C.溶液pH=7时c(H+)=c(OH-),电荷守恒关系为c(NH4+)+c(H+)=c(OH-)+c(Cl-),则溶液中c(NH4+)=c(Cl-),故C错误;
D.一水合氨是弱碱,pH=11氨水中c(NH3)>10-14-(-11)mol/L=0.001mol/L,pH=3盐酸中c(HCl)=0.001mol/L,等体积混合后氨水过量,则混合溶液的pH>7,故D正确;
故答案为:D;
(2)2.0mol•L-1氨水溶液中的c(OH-)=$\sqrt{cK{}_{b}}$=$\sqrt{2.0×1.8×10{}^{-5}}$mol/L=6.0×10-3mol/L;将SO2通入该氨水中,当c(OH−)降至1.0×10-7mol•L-1时,c(H+)=1.0×10-7mol•L-1,则溶液中的$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$=$\frac{K{}_{a2}}{c(H{}^{+})}$=$\frac{6.2×10{}^{-8}}{1.0×10{}^{-7}}$=0.62,
故答案为:6.0×10-3;0.62;
(3)①曲线A所对应的温度下Kw=c(OH-)×c(H+)=10-7×10-7=10-14,pH=2的HCl溶液中由水的电离c(H+)=溶液中c(OH-)=$\frac{10{}^{-14}}{10{}^{-2}}$mol/L=10-12mol/L,pH=12的BOH溶液中,若水的电离由水的电离c(H+)=10-12mol/L,则二者的电离程度相等,即α1等于α2;BOH可能是强碱,也可能是弱碱,则pH=12的BOH溶液中c(BOH)≥$\frac{10{}^{-14}}{10{}^{-12}}$mol/L=0.02mol/L,所以pH=2的HCl溶液和pH=12的BOH溶液等体积混合后pH>7或pH=7,,
故答案为:等于;≥;
②曲线B所对应的温度下Kw=c(OH-)×c(H+)=10-6×10-6=10-12,0.02mol•L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,Ba(OH)2过量一半,则混合溶液中c(OH-)=$\frac{0.02×2-0.02}{2}$mol/L=0.01mol/L,c(H+)=$\frac{K{}_{w}}{c(OH{}^{-})}$=$\frac{10{}^{-12}}{0.01}$mol/L=10-10mol/L,pH=-lgc(H+)=-lg10-10=10,
故答案为:10;
③另一温度下测得0.01mol•L-1的NaOH溶液的pH为11,则Kw=c(OH-)×c(H+)=0.01×10-11=10-13,且a=12,b=2,pH=a的NaOH溶液中c(OH-)=$\frac{10{}^{-13}}{10{}^{-12}}$mol/l=0.1mol/L,pH=b的硫酸中c(H+)=0.01mol/L,混合溶液的pH=10,呈碱性,则NaOH过量,混合溶液中c(OH-)=$\frac{10{}^{-13}}{10{}^{-10}}$mol/L=0.001mol/L,则混合溶液中n(OH-)=0.001(Va+Vb)mol=0.1molVa-0.01Vb,得到Va:Vb=1:9,
故答案为:1:9;
(4)溶液中存在的电荷守恒关系为c(NH4+)+c(H+)=c(OH-)+c(Cl-),反应平衡时溶液中c(NH4+)=c(Cl-),则平衡时溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=$\frac{1}{2}$×0.01mol/L=0.005mol/L,NH4Cl溶液呈酸性,所以混合溶液中氨水过量,c(NH3•H2O)=$\frac{1}{2}$(a-0.01)mol/L,NH3•H2O的电离常数Kb=$\frac{c(N{H}_{4}{}^{+})•c(OH{}^{-})}{c(NH{}_{3}•H{}_{2}O)}$=$\frac{0.005×10{}^{-7}}{\frac{1}{2}(a-0.01)}$=$\frac{10{}^{-9}}{a-0.01}$,
故答案为:$\frac{10{}^{-9}}{a-0.01}$。
B.0.1mol/L氨水中c(OH-)<0.1mol/L,溶液的pH<13,稀释到原来的100倍时促进氨水电离,pH变化小于2个单位,则①的pH与②不同,故B错误;
C.溶液pH=7时c(H+)=c(OH-),电荷守恒关系为c(NH4+)+c(H+)=c(OH-)+c(Cl-),则溶液中c(NH4+)=c(Cl-),故C错误;
D.一水合氨是弱碱,pH=11氨水中c(NH3)>10-14-(-11)mol/L=0.001mol/L,pH=3盐酸中c(HCl)=0.001mol/L,等体积混合后氨水过量,则混合溶液的pH>7,故D正确;
故答案为:D;
(2)2.0mol•L-1氨水溶液中的c(OH-)=$\sqrt{cK{}_{b}}$=$\sqrt{2.0×1.8×10{}^{-5}}$mol/L=6.0×10-3mol/L;将SO2通入该氨水中,当c(OH−)降至1.0×10-7mol•L-1时,c(H+)=1.0×10-7mol•L-1,则溶液中的$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$=$\frac{K{}_{a2}}{c(H{}^{+})}$=$\frac{6.2×10{}^{-8}}{1.0×10{}^{-7}}$=0.62,
故答案为:6.0×10-3;0.62;
(3)①曲线A所对应的温度下Kw=c(OH-)×c(H+)=10-7×10-7=10-14,pH=2的HCl溶液中由水的电离c(H+)=溶液中c(OH-)=$\frac{10{}^{-14}}{10{}^{-2}}$mol/L=10-12mol/L,pH=12的BOH溶液中,若水的电离由水的电离c(H+)=10-12mol/L,则二者的电离程度相等,即α1等于α2;BOH可能是强碱,也可能是弱碱,则pH=12的BOH溶液中c(BOH)≥$\frac{10{}^{-14}}{10{}^{-12}}$mol/L=0.02mol/L,所以pH=2的HCl溶液和pH=12的BOH溶液等体积混合后pH>7或pH=7,,
故答案为:等于;≥;
②曲线B所对应的温度下Kw=c(OH-)×c(H+)=10-6×10-6=10-12,0.02mol•L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,Ba(OH)2过量一半,则混合溶液中c(OH-)=$\frac{0.02×2-0.02}{2}$mol/L=0.01mol/L,c(H+)=$\frac{K{}_{w}}{c(OH{}^{-})}$=$\frac{10{}^{-12}}{0.01}$mol/L=10-10mol/L,pH=-lgc(H+)=-lg10-10=10,
故答案为:10;
③另一温度下测得0.01mol•L-1的NaOH溶液的pH为11,则Kw=c(OH-)×c(H+)=0.01×10-11=10-13,且a=12,b=2,pH=a的NaOH溶液中c(OH-)=$\frac{10{}^{-13}}{10{}^{-12}}$mol/l=0.1mol/L,pH=b的硫酸中c(H+)=0.01mol/L,混合溶液的pH=10,呈碱性,则NaOH过量,混合溶液中c(OH-)=$\frac{10{}^{-13}}{10{}^{-10}}$mol/L=0.001mol/L,则混合溶液中n(OH-)=0.001(Va+Vb)mol=0.1molVa-0.01Vb,得到Va:Vb=1:9,
故答案为:1:9;
(4)溶液中存在的电荷守恒关系为c(NH4+)+c(H+)=c(OH-)+c(Cl-),反应平衡时溶液中c(NH4+)=c(Cl-),则平衡时溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=$\frac{1}{2}$×0.01mol/L=0.005mol/L,NH4Cl溶液呈酸性,所以混合溶液中氨水过量,c(NH3•H2O)=$\frac{1}{2}$(a-0.01)mol/L,NH3•H2O的电离常数Kb=$\frac{c(N{H}_{4}{}^{+})•c(OH{}^{-})}{c(NH{}_{3}•H{}_{2}O)}$=$\frac{0.005×10{}^{-7}}{\frac{1}{2}(a-0.01)}$=$\frac{10{}^{-9}}{a-0.01}$,
故答案为:$\frac{10{}^{-9}}{a-0.01}$。