一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、等。 甲组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。 ①无水为催化剂,a瓶中发生反应的化学方程式为____,如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____。 ②装置B的主要作用是____。 收集到的气体在氧气中充分燃烧,产物用过量的 溶液充分吸收,以甲基橙作指示剂,用盐酸标准液对吸收液进行滴定(发生的反应为:,),当观察到____时即达到滴定终点,消耗盐酸。则所收集的物质的量为____mol。(已知:) 乙组同学选用甲组装置A、B和如图所示的部分装置检验中的氯元素。(已知:) ①乙组同学的实验装置中,依次连接的合理顺序为A、B、____。 ②通入一段时间的气体,打开装置D中分液漏斗的活塞,观察实验现象。分液漏斗中盛放的试剂是____。 ③能证明中含有氯元素的实验现象是____。
一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、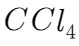 等。
等。
甲组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
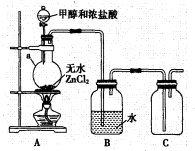
①无水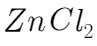 为催化剂,a瓶中发生反应的化学方程式为____,如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____。
为催化剂,a瓶中发生反应的化学方程式为____,如果实验时a瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____。
②装置B的主要作用是____。
收集到的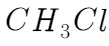 气体在氧气中充分燃烧,产物用过量的
气体在氧气中充分燃烧,产物用过量的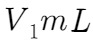
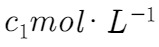
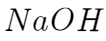 溶液充分吸收,以甲基橙作指示剂,用
溶液充分吸收,以甲基橙作指示剂,用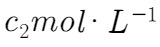 盐酸标准液对吸收液进行滴定(发生的反应为:
盐酸标准液对吸收液进行滴定(发生的反应为: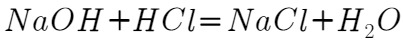 ,
,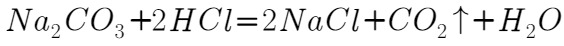 ),当观察到____时即达到滴定终点,消耗
),当观察到____时即达到滴定终点,消耗 盐酸。则所收集
盐酸。则所收集 的物质的量为____mol。(已知:
的物质的量为____mol。(已知: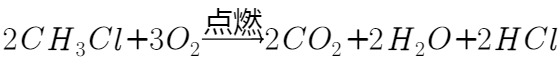 )
)
乙组同学选用甲组装置A、B和如图所示的部分装置检验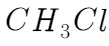 中的氯元素。(已知:
中的氯元素。(已知: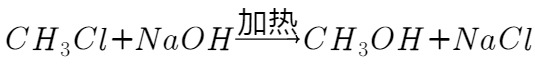 )
)
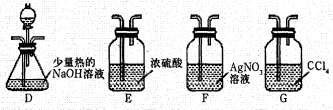
①乙组同学的实验装置中,依次连接的合理顺序为A、B、____。
②通入一段时间的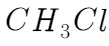 气体,打开装置D中分液漏斗的活塞,观察实验现象。分液漏斗中盛放的试剂是____。
气体,打开装置D中分液漏斗的活塞,观察实验现象。分液漏斗中盛放的试剂是____。
③能证明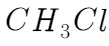 中含有氯元素的实验现象是____。
中含有氯元素的实验现象是____。
题目解答
答案
1. 【答案】
①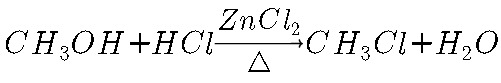 ;
;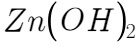
②除去氯化氢气体和甲醇
【解析】
①甲醇和浓盐酸在无水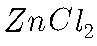 的条件下反应,其化学方程式为:
的条件下反应,其化学方程式为: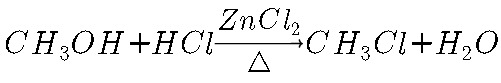 ;如果加热时间过长,会发生
;如果加热时间过长,会发生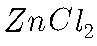 的水解反应,会得到白色的物质,其化学式为:
的水解反应,会得到白色的物质,其化学式为: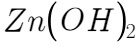 或者
或者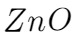 。
。
故答案为: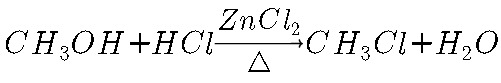 ;
;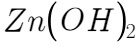 。
。
②因为产生的气体中会夹杂未反应的盐酸和甲醇,因此C装置的作用是除去氯化氢气体和甲醇。
故答案为:除去氯化氢气体和甲醇。
2. 【答案】
滴入最后一滴盐酸,溶液恰好由黄色变成橙色,且半分钟不变;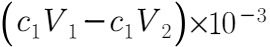
【解析】
滴定反应的终点会有颜色的突变,即当滴入最后一滴盐酸,溶液恰好由黄色变成橙色,且半分钟不变;
用已知量的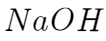 去吸收反应产生的气体,然后再用盐酸去滴定未反应完的
去吸收反应产生的气体,然后再用盐酸去滴定未反应完的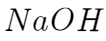 ,最后计算得到
,最后计算得到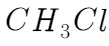 的物质的量:
的物质的量: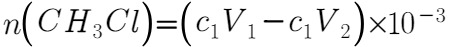 。
。
故答案为:滴入最后一滴盐酸,溶液恰好由黄色变成橙色,且半分钟不变;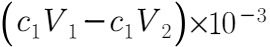 。
。
3. 【答案】
①F、D、G
②硝酸酸化的硝酸银溶液
③F中无白色沉淀生成,D中有白色沉淀生成
【解析】
①乙组同学的实验思路是:用A装置制备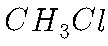 ,用B装置除去氯化氢气体和甲醇,用F装置验证气体中的氯化氢被B装置完全吸收,用D装置验证
,用B装置除去氯化氢气体和甲醇,用F装置验证气体中的氯化氢被B装置完全吸收,用D装置验证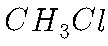 中氯元素,用G装置除去气体中的
中氯元素,用G装置除去气体中的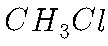 ,避免污染空气。
,避免污染空气。
故答案为:F、D、G。
②分液漏斗中盛放的试剂为硝酸酸化的硝酸银溶液。
故答案为:硝酸酸化的硝酸银溶液。
③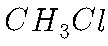 中有氯元素的实验现象为:F中无白色沉淀生成,因此气体中的氯化氢气体被B装置完全吸收,D中有白色沉淀生成,即
中有氯元素的实验现象为:F中无白色沉淀生成,因此气体中的氯化氢气体被B装置完全吸收,D中有白色沉淀生成,即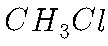 中有氯元素。
中有氯元素。
故答案为:F中无白色沉淀生成,D中有白色沉淀生成。
解析
甲醇和浓盐酸在无水ZnCl2的催化作用下反应生成一氯甲烷和水,化学方程式为$C{H}_{3}OH+HCl\xrightarrow [\Delta ]{Zn{Cl}_{2}}C{H}_{3}Cl+{H}_{2}O$。如果加热时间过长,ZnCl2会水解生成$Zn{(OH)}_{2}$。
步骤 2:装置B的作用
装置B的作用是除去未反应的氯化氢气体和甲醇,以确保收集到的气体纯净。
步骤 3:滴定终点的判断和计算
滴定终点的判断是当滴入最后一滴盐酸,溶液恰好由黄色变成橙色,且半分钟不变。根据滴定反应,计算出CH3Cl的物质的量。
步骤 4:乙组实验装置的连接顺序
乙组实验装置的连接顺序为A、B、F、D、G,以验证CH3Cl中氯元素的存在。
步骤 5:分液漏斗中盛放的试剂
分液漏斗中盛放的试剂是硝酸酸化的硝酸银溶液,用于检测氯离子。
步骤 6:证明CH3Cl中含有氯元素的实验现象
证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成。