题目
12.计算1mol甲苯在其正常沸点(100kPa、110℃)蒸发为蒸气时的W、Q、 △U Delta H 、-|||-△S Delta G 。已知该温度下甲苯的气化热是 .5kJcdot (mol)^-1 ,可将甲苯蒸气看作理想气体。

题目解答
答案
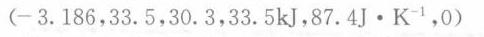
解析
步骤 1:计算W(功)
在等压过程中,功的计算公式为 $W = -P\Delta V$,其中 $P$ 是压力,$\Delta V$ 是体积变化。由于甲苯从液态变为气态,体积会显著增加,但因为是等压过程,我们可以直接使用气化热来计算功。对于理想气体,$W = -nRT\ln\frac{V_2}{V_1}$,但由于 $V_1$ 远小于 $V_2$,我们可以近似认为 $W = -nRT\ln\frac{V_2}{V_1} \approx -nRT$,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T$ 是温度。因此,$W = -1mol \times 8.314J\cdot mol^{-1}\cdot K^{-1} \times 383K = -3.186kJ$。
步骤 2:计算Q(热量)
在等压过程中,热量的计算公式为 $Q = \Delta H$,其中 $\Delta H$ 是焓变。题目中给出的气化热就是焓变,因此 $Q = 33.5kJ$。
步骤 3:计算$\Delta U$(内能变化)
内能变化的计算公式为 $\Delta U = Q + W$。将步骤 2 和步骤 1 中的值代入,得到 $\Delta U = 33.5kJ - 3.186kJ = 30.3kJ$。
步骤 4:计算$\Delta S$(熵变)
熵变的计算公式为 $\Delta S = \frac{\Delta H}{T}$,其中 $T$ 是温度。将步骤 2 中的值代入,得到 $\Delta S = \frac{33.5kJ}{383K} = 87.4J\cdot K^{-1}$。
步骤 5:计算$\Delta G$(吉布斯自由能变化)
吉布斯自由能变化的计算公式为 $\Delta G = \Delta H - T\Delta S$。将步骤 2 和步骤 4 中的值代入,得到 $\Delta G = 33.5kJ - 383K \times 87.4J\cdot K^{-1} = 0$。
在等压过程中,功的计算公式为 $W = -P\Delta V$,其中 $P$ 是压力,$\Delta V$ 是体积变化。由于甲苯从液态变为气态,体积会显著增加,但因为是等压过程,我们可以直接使用气化热来计算功。对于理想气体,$W = -nRT\ln\frac{V_2}{V_1}$,但由于 $V_1$ 远小于 $V_2$,我们可以近似认为 $W = -nRT\ln\frac{V_2}{V_1} \approx -nRT$,其中 $n$ 是摩尔数,$R$ 是理想气体常数,$T$ 是温度。因此,$W = -1mol \times 8.314J\cdot mol^{-1}\cdot K^{-1} \times 383K = -3.186kJ$。
步骤 2:计算Q(热量)
在等压过程中,热量的计算公式为 $Q = \Delta H$,其中 $\Delta H$ 是焓变。题目中给出的气化热就是焓变,因此 $Q = 33.5kJ$。
步骤 3:计算$\Delta U$(内能变化)
内能变化的计算公式为 $\Delta U = Q + W$。将步骤 2 和步骤 1 中的值代入,得到 $\Delta U = 33.5kJ - 3.186kJ = 30.3kJ$。
步骤 4:计算$\Delta S$(熵变)
熵变的计算公式为 $\Delta S = \frac{\Delta H}{T}$,其中 $T$ 是温度。将步骤 2 中的值代入,得到 $\Delta S = \frac{33.5kJ}{383K} = 87.4J\cdot K^{-1}$。
步骤 5:计算$\Delta G$(吉布斯自由能变化)
吉布斯自由能变化的计算公式为 $\Delta G = \Delta H - T\Delta S$。将步骤 2 和步骤 4 中的值代入,得到 $\Delta G = 33.5kJ - 383K \times 87.4J\cdot K^{-1} = 0$。