题目
少量Na2O2与H2O反应生成H2O2和NaOH.下列说法正确的是( )A. Na2O2中阴阳离子的个数比为1:1B. H2O 的分子模型:C. H2O2中O元素的化合价为-1D. NaOH是弱电解质
少量Na2O2与H2O反应生成H2O2和NaOH.下列说法正确的是( )
- A. Na2O2中阴阳离子的个数比为1:1
- B. H2O 的分子模型:
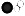
- C. H2O2中O元素的化合价为-1
- D. NaOH是弱电解质
题目解答
答案
C. H2O2中O元素的化合价为-1
解析
步骤 1:分析Na_2O_2的组成
Na_2O_2中阳离子为Na^{+},阴离子为${O}_{2}^{2-}$,阴阳离子的个数比为1:2,因此选项A错误。
步骤 2:分析H_2O的分子模型
H_2O的分子模型是V型,O原子在中间,因此选项B错误。
步骤 3:分析H_2O_2中O元素的化合价
根据化合物中,正负化合价的代数和为0,H_2O_2中H为+1价,O元素的化合价为-1,因此选项C正确。
步骤 4:分析NaOH的性质
NaOH是强碱,在水溶液中能完全电离,是强电解质,因此选项D错误。
Na_2O_2中阳离子为Na^{+},阴离子为${O}_{2}^{2-}$,阴阳离子的个数比为1:2,因此选项A错误。
步骤 2:分析H_2O的分子模型
H_2O的分子模型是V型,O原子在中间,因此选项B错误。
步骤 3:分析H_2O_2中O元素的化合价
根据化合物中,正负化合价的代数和为0,H_2O_2中H为+1价,O元素的化合价为-1,因此选项C正确。
步骤 4:分析NaOH的性质
NaOH是强碱,在水溶液中能完全电离,是强电解质,因此选项D错误。