题目
中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4),回答下列问题:(1)基态Fe原子的价电子排布式为 ____ ,橄榄石中,各元素电负性大小顺序为 ____ ,铁的化合价为 ____ 。(2)已知一些物质的熔点数据如下表: 物质 熔点/℃ NaCl 800.7 SiCl4 -68.8 GeCl4 -51.5 SnCl4 -34.1 Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4。原因是 ____ 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因 ____ 。SiCl4的空间结构为 ____ ,其中Si的轨道杂化形式为 ____ 。(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 ____ 个Mg。该物质化学式为 ____ ,B-B最近距离为 ____ 。aw D-|||--C-|||-D o-|||-D-|||-。d乙L x-|||-8
中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4),回答下列问题:
(1)基态Fe原子的价电子排布式为 ____ ,橄榄石中,各元素电负性大小顺序为 ____ ,铁的化合价为 ____ 。
(2)已知一些物质的熔点数据如下表:
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4。原因是 ____ 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因 ____ 。SiCl4的空间结构为 ____ ,其中Si的轨道杂化形式为 ____ 。
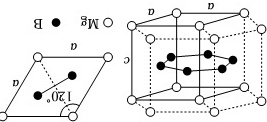
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 ____ 个Mg。该物质化学式为 ____ ,B-B最近距离为 ____ 。
(1)基态Fe原子的价电子排布式为 ____ ,橄榄石中,各元素电负性大小顺序为 ____ ,铁的化合价为 ____ 。
(2)已知一些物质的熔点数据如下表:
| 物质 | 熔点/℃ |
| NaCl | 800.7 |
| SiCl4 | -68.8 |
| GeCl4 | -51.5 |
| SnCl4 | -34.1 |
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有 ____ 个Mg。该物质化学式为 ____ ,B-B最近距离为 ____ 。

题目解答
答案
解:(1)Fe为26号元素,价电子排布式为:3d64s2;非金属性越强电负性越大,橄榄石中含有Mg、Fe、Si、O四种元素,因此电负性大小顺序为:O>Si>Fe>Mg;化合物MgxFe2-xSiO4中Mg元素的化合价为+2价,Si元素的化合价为+4价,O元素的化合价为-2价,根据各元素的代数和为0,可知Fe元素的化合价为+2价,
故答案为:3d64s2;O>Si>Fe>Mg;+2;
(2)NaCl为离子晶体,SiCl4为分子晶体,离子晶体的熔点高于分子晶体,因此NaCl熔点明显高于SiCl4;SiCl4、GeCl4、SnCl4均为分子晶体,相对分子质量逐渐增大,随着相对分子质量的增大,熔沸点逐渐升高;SiCl4的价电子对数为:$\frac{4+4}{2}$=4,孤电子对数为0,因此SiCl4的空间构型为正四面体形,Si的轨道杂化形式为sp3杂化,
故答案为:NaCl为离子晶体,SiCl4为分子晶体,离子晶体的熔点高于分子晶体;SiCl4、GeCl4、SnCl4均为分子晶体,相对分子质量逐渐增大,随着相对分子质量的增大,熔沸点逐渐升高;正四面体形;sp3杂化;
(3)根据均摊法,晶胞中含有的Mg原子的个数为:4×$\frac{1}{6}$+4×$\frac{1}{12}$=1,B原子的个数为1,因此该物质的化学式为MgB2;晶胞沿c轴的投影图可知,B-B间最近距离为边长a的两个正三角形重心间的距离,因此B-B最近距离为$\frac{\sqrt{3}}{3}a$,
故答案为:1;MgB2;$\frac{\sqrt{3}}{3}a$。
故答案为:3d64s2;O>Si>Fe>Mg;+2;
(2)NaCl为离子晶体,SiCl4为分子晶体,离子晶体的熔点高于分子晶体,因此NaCl熔点明显高于SiCl4;SiCl4、GeCl4、SnCl4均为分子晶体,相对分子质量逐渐增大,随着相对分子质量的增大,熔沸点逐渐升高;SiCl4的价电子对数为:$\frac{4+4}{2}$=4,孤电子对数为0,因此SiCl4的空间构型为正四面体形,Si的轨道杂化形式为sp3杂化,
故答案为:NaCl为离子晶体,SiCl4为分子晶体,离子晶体的熔点高于分子晶体;SiCl4、GeCl4、SnCl4均为分子晶体,相对分子质量逐渐增大,随着相对分子质量的增大,熔沸点逐渐升高;正四面体形;sp3杂化;
(3)根据均摊法,晶胞中含有的Mg原子的个数为:4×$\frac{1}{6}$+4×$\frac{1}{12}$=1,B原子的个数为1,因此该物质的化学式为MgB2;晶胞沿c轴的投影图可知,B-B间最近距离为边长a的两个正三角形重心间的距离,因此B-B最近距离为$\frac{\sqrt{3}}{3}a$,
故答案为:1;MgB2;$\frac{\sqrt{3}}{3}a$。
解析
步骤 1:基态Fe原子的价电子排布式
Fe为26号元素,其电子排布式为1s^22s^22p^63s^23p^63d^64s^2,因此价电子排布式为3d^64s^2。
步骤 2:橄榄石中各元素电负性大小顺序
橄榄石中含有Mg、Fe、Si、O四种元素,根据电负性大小顺序,O>Si>Fe>Mg。
步骤 3:铁的化合价
化合物Mg_xFe_2-xSiO_4中Mg元素的化合价为+2价,Si元素的化合价为+4价,O元素的化合价为-2价,根据各元素的代数和为0,可知Fe元素的化合价为+2价。
步骤 4:NaCl熔点高于SiCl_4的原因
NaCl为离子晶体,SiCl_4为分子晶体,离子晶体的熔点高于分子晶体。
步骤 5:同族元素的氯化物熔点变化趋势及其原因
SiCl_4、GeCl_4、SnCl_4均为分子晶体,相对分子质量逐渐增大,随着相对分子质量的增大,熔沸点逐渐升高。
步骤 6:SiCl_4的空间结构和Si的轨道杂化形式
SiCl_4的价电子对数为:$\frac{4+4}{2}$=4,孤电子对数为0,因此SiCl_4的空间构型为正四面体形,Si的轨道杂化形式为sp^3杂化。
步骤 7:晶胞中Mg原子的个数
根据均摊法,晶胞中含有的Mg原子的个数为:4×$\frac{1}{6}$+4×$\frac{1}{12}$=1。
步骤 8:该物质的化学式
B原子的个数为1,因此该物质的化学式为MgB_2。
步骤 9:B-B最近距离
晶胞沿c轴的投影图可知,B-B间最近距离为边长a的两个正三角形重心间的距离,因此B-B最近距离为$\frac{\sqrt{3}}{3}a$。
Fe为26号元素,其电子排布式为1s^22s^22p^63s^23p^63d^64s^2,因此价电子排布式为3d^64s^2。
步骤 2:橄榄石中各元素电负性大小顺序
橄榄石中含有Mg、Fe、Si、O四种元素,根据电负性大小顺序,O>Si>Fe>Mg。
步骤 3:铁的化合价
化合物Mg_xFe_2-xSiO_4中Mg元素的化合价为+2价,Si元素的化合价为+4价,O元素的化合价为-2价,根据各元素的代数和为0,可知Fe元素的化合价为+2价。
步骤 4:NaCl熔点高于SiCl_4的原因
NaCl为离子晶体,SiCl_4为分子晶体,离子晶体的熔点高于分子晶体。
步骤 5:同族元素的氯化物熔点变化趋势及其原因
SiCl_4、GeCl_4、SnCl_4均为分子晶体,相对分子质量逐渐增大,随着相对分子质量的增大,熔沸点逐渐升高。
步骤 6:SiCl_4的空间结构和Si的轨道杂化形式
SiCl_4的价电子对数为:$\frac{4+4}{2}$=4,孤电子对数为0,因此SiCl_4的空间构型为正四面体形,Si的轨道杂化形式为sp^3杂化。
步骤 7:晶胞中Mg原子的个数
根据均摊法,晶胞中含有的Mg原子的个数为:4×$\frac{1}{6}$+4×$\frac{1}{12}$=1。
步骤 8:该物质的化学式
B原子的个数为1,因此该物质的化学式为MgB_2。
步骤 9:B-B最近距离
晶胞沿c轴的投影图可知,B-B间最近距离为边长a的两个正三角形重心间的距离,因此B-B最近距离为$\frac{\sqrt{3}}{3}a$。