题目
向 CH3COOH CH3COO−+H+ 的平衡体系中 , 加入下列物质能使醋酸的电离程度和溶液的 pH 都变小的是 ( ) A. H2O B. CH3COONa C. NH3⋅H2O D. H2SO4
向
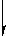
A.
B.
C.
D.
题目解答
答案
解析
步骤 1:理解醋酸的电离平衡
醋酸(CH3COOH)在水溶液中部分电离为醋酸根离子(CH3COO−)和氢离子(H+),形成电离平衡。电离平衡的表达式为:CH3COOH ⇌ CH3COO− + H+。
步骤 2:分析加入物质对电离平衡的影响
A. H2O:加入水会稀释溶液,使电离平衡向右移动,但同时也会降低氢离子浓度,使pH增大。
B. CH3COONa:加入醋酸钠会增加醋酸根离子的浓度,根据勒夏特列原理,平衡会向左移动,减少醋酸的电离程度,pH增大。
C. NH3⋅H2O:加入氨水会与氢离子反应,减少氢离子浓度,平衡向右移动,但pH增大。
D. H2SO4:加入硫酸会增加氢离子浓度,平衡向左移动,减少醋酸的电离程度,但同时氢离子浓度增加,pH减小。
步骤 3:选择正确答案
根据上述分析,只有加入硫酸(H2SO4)会同时减少醋酸的电离程度和降低溶液的pH值。
醋酸(CH3COOH)在水溶液中部分电离为醋酸根离子(CH3COO−)和氢离子(H+),形成电离平衡。电离平衡的表达式为:CH3COOH ⇌ CH3COO− + H+。
步骤 2:分析加入物质对电离平衡的影响
A. H2O:加入水会稀释溶液,使电离平衡向右移动,但同时也会降低氢离子浓度,使pH增大。
B. CH3COONa:加入醋酸钠会增加醋酸根离子的浓度,根据勒夏特列原理,平衡会向左移动,减少醋酸的电离程度,pH增大。
C. NH3⋅H2O:加入氨水会与氢离子反应,减少氢离子浓度,平衡向右移动,但pH增大。
D. H2SO4:加入硫酸会增加氢离子浓度,平衡向左移动,减少醋酸的电离程度,但同时氢离子浓度增加,pH减小。
步骤 3:选择正确答案
根据上述分析,只有加入硫酸(H2SO4)会同时减少醋酸的电离程度和降低溶液的pH值。