N2O(g)的热分解反应为2N2O(g)==2N2(g)+O2(g),在一定温度下,反应的半衰期与初始压力成反比。在970K时,N2O(g)的初始压力为39.2kPa,测得半衰期为1529s,在1030K时,N2O(g)的初始压力为48.0kPa,测得半衰期为212s。(1) 判断该反应的级数;(2) 计算两个温度下的速率常数;(3) 求反应的实验活化能;(4) 在1030K,当N2O(g)的初始压力为53.3kPa时,计算总压达到64.0kPa所需的时间。
N2O(g)的热分解反应为2N2O(g)==2N2(g)+O2(g),在一定温度下,反应的半衰期与初始压力成反比。在970K时,N2O(g)的初始压力为39.2kPa,测得半衰期为1529s,在1030K时,N2O(g)的初始压力为48.0kPa,测得半衰期为212s。
(1) 判断该反应的级数;
(2) 计算两个温度下的速率常数;
(3) 求反应的实验活化能;
(4) 在1030K,当N2O(g)的初始压力为53.3kPa时,计算总压达到64.0kPa所需的时间。
题目解答
答案
解: 2N2O(g) == 2N2(g) + O2(g)
t=0 a 0 0
t=t a–x x 0.5x
(1) 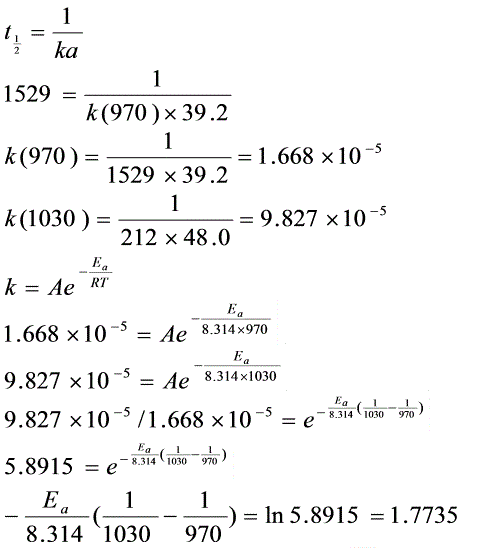 反应的半衰期与初始压力成反比,说明反应级数为二级。
反应的半衰期与初始压力成反比,说明反应级数为二级。
(2)
kPas
kPa-1.s-1
(3)
34解:
不考虑水的离解对离子强度的影响:
I=1/2×{1.0×10×1 +1.0×10×(–1)}= 1.0×10molkg
r=0.9988
K=aa=a=( rm/m)= r(νν)m/m= rm
=0.9988 ×(1.0×10-4)2=9.976×10-4
(1) ∵AgA的浓度远低于NaNO的浓度,∴离子强度由NaNO提供:
Isp=1/2×{0.1×1ө +0.1×(–1)Ag}= 0.1mol+kgA
r3=0.69
K=aa=a=( rm/m)= r(νν)m/m= rm
r m2=9.988×102,m.=1.4475×10-1 molkg
(2) 离子强度由HNO提供:
I±=1/2×{1.0×10×1 +1.0×10× (–1)}= 0.001molkg
r±=0.964
K3=aa=rm r m/ m= r m m=9.976×10
m -3=1.3×102 mol-3kg2
m=8.257×10molkg
m±=(8.7×10+8.257×10)=9.526×10molkg
msp=(1.3×10ө-8.257×10Ag+)=4.743×10.molA-kgAg
EAg=1.7735×8.314×1030×970/(1030-970)=245.53kJ+mol-4
(4)
pH=a+0.5x=53.3 + 0.5x=64.0
x=21.4kPa
(53.3–21.4)–53.3=9.827×10t
t=128s
解析
反应的半衰期与初始压力成反比,说明反应级数为二级。
步骤 2:计算两个温度下的速率常数
根据二级反应的半衰期公式 ${t}_{\dfrac {1}{2}}=\dfrac {1}{ka}$,可以计算出两个温度下的速率常数。
步骤 3:求反应的实验活化能
利用阿伦尼乌斯方程 $k=A{e}^{-\dfrac {Ea}{RT}}$,通过两个温度下的速率常数计算实验活化能。
步骤 4:计算总压达到64.0kPa所需的时间
根据二级反应的速率方程,计算在1030K时,N2O(g)的初始压力为53.3kPa时,总压达到64.0kPa所需的时间。