题目
5.1mol理想气体在122K等温的情况下,反抗恒定外压10.15 kPa,从10 dm^3膨胀到终态体积-|||-100.0dm^3,试计算Q、W、 Delta U 和 Delta H 。

题目解答
答案
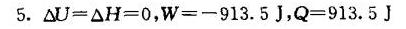
解析
考查要点:本题主要考查理想气体在等温过程中的热力学量计算,包括功(W)、热量(Q)、内能变化(ΔU)和焓变(ΔH)。
解题核心思路:
- 等温过程性质:理想气体的内能和焓仅是温度的函数,因此等温时ΔU=0,ΔH=0。
- 功的计算:气体反抗恒定外压膨胀时,功的计算公式为 $W = -P_{\text{外}} \cdot \Delta V$,需注意单位换算。
- 热量计算:根据热力学第一定律 $\Delta U = Q + W$,结合已知ΔU和W求Q。
步骤1:确定ΔU和ΔH
理想气体在等温过程中,温度不变,因此:
$\Delta U = 0, \quad \Delta H = 0$
步骤2:计算功W
气体从体积$V_1 = 10 \, \text{dm}^3$膨胀到$V_2 = 100 \, \text{dm}^3$,体积变化为:
$\Delta V = V_2 - V_1 = 90 \, \text{dm}^3 = 0.09 \, \text{m}^3$
恒定外压$P_{\text{外}} = 10.15 \, \text{kPa} = 10150 \, \text{Pa}$,则功为:
$W = -P_{\text{外}} \cdot \Delta V = -10150 \, \text{Pa} \cdot 0.09 \, \text{m}^3 = -913.5 \, \text{J}$
步骤3:计算热量Q
根据热力学第一定律$\Delta U = Q + W$,代入$\Delta U = 0$和$W = -913.5 \, \text{J}$:
$0 = Q + (-913.5 \, \text{J}) \implies Q = 913.5 \, \text{J}$