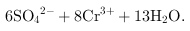题目
铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态.工业上以铬铁矿(主要成分为FeO•Cr2O3,含有Cr2O3、Cr2O3等杂质)为主要原料生产金属铬和重铬酸钠Cr2O3•Cr2O3(已知Cr2O3是一种强氧化剂),其主要工艺流程如图Cr2O3 Cr2O3 查阅资料得知: ①常温下,Cr2O3不溶于水,有强氧化性,在碱性条件下,能将Cr2O3转化为Cr2O3②常温下,Cr2O3回答下列问题: (1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 . (2)酸化滤液D时,不选用盐酸的原因是 . (3)固体E的主要成分是Cr2O3,根据图2分析操作a为 、 . (4)已知含+6价铬的污水会污染环境.电镀厂产生的镀铜废水中往往含有一定量的Cr2O3,处理该废水常用还原沉淀法,具体流程如下: 含Cr2O3的废水Cr2O3含Cr2O3的废水Cr2O3沉淀 ①Cr2O3的化学性质与Cr2O3相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,用离子方程式表示其原因 ; ②下列溶液中可以代替上述流程中Cr2O3溶液的是 (填选项序号); Cr2O3溶液 B.浓Cr2O3 C.酸性Cr2O3溶液Cr2O3溶液 ③调整溶液的Cr2O3时,通过列式计算说明溶液中的Cr2O3是否沉淀完全 ; ④上述流程中,每消耗Cr2O3转移Cr2O3,则加入Cr2O3溶液时发生反应的离子方程式为 .
铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态.工业上以铬铁矿(主要成分为FeO•
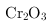 ,含有
,含有
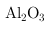 、
、
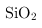 等杂质)为主要原料生产金属铬和重铬酸钠
等杂质)为主要原料生产金属铬和重铬酸钠
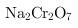 •
•
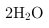 (已知
(已知
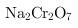 是一种强氧化剂),其主要工艺流程如图
是一种强氧化剂),其主要工艺流程如图
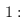
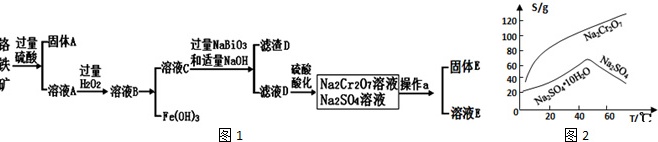
查阅资料得知:
①常温下,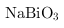 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将
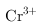 转化为
转化为
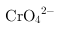
②常温下,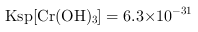
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以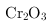 为原料,利用铝热反应制取金属铬的化学方程式
.
为原料,利用铝热反应制取金属铬的化学方程式
.
(2)酸化滤液D时,不选用盐酸的原因是
.
(3)固体E的主要成分是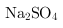 ,根据图2分析操作a为
、
.
,根据图2分析操作a为
、
.
(4)已知含+6价铬的污水会污染环境.电镀厂产生的镀铜废水中往往含有一定量的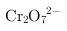 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
含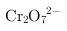 的废水
的废水
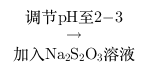 含
含
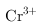 的废水
的废水
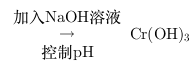 沉淀
沉淀
①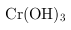 的化学性质与
的化学性质与
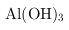 相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,用离子方程式表示其原因
;
相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,用离子方程式表示其原因
;
②下列溶液中可以代替上述流程中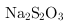 溶液的是
(填选项序号);
溶液的是
(填选项序号);
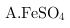 溶液 B.浓
溶液 B.浓
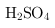 C.酸性
C.酸性
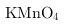 溶液
溶液
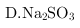 溶液
溶液
③调整溶液的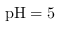 时,通过列式计算说明溶液中的
时,通过列式计算说明溶液中的
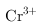 是否沉淀完全
;
是否沉淀完全
;
④上述流程中,每消耗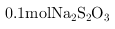 转移
转移
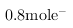 ,则加入
,则加入
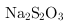 溶液时发生反应的离子方程式为
.
溶液时发生反应的离子方程式为
.
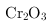 ,含有
,含有
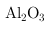 、
、
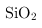 等杂质)为主要原料生产金属铬和重铬酸钠
等杂质)为主要原料生产金属铬和重铬酸钠
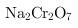 •
•
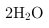 (已知
(已知
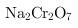 是一种强氧化剂),其主要工艺流程如图
是一种强氧化剂),其主要工艺流程如图
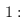

查阅资料得知:
①常温下,
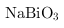 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将
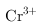 转化为
转化为
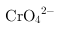
②常温下,
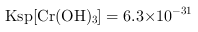
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以
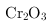 为原料,利用铝热反应制取金属铬的化学方程式
为原料,利用铝热反应制取金属铬的化学方程式
(2)酸化滤液D时,不选用盐酸的原因是
(3)固体E的主要成分是
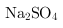 ,根据图2分析操作a为
,根据图2分析操作a为
(4)已知含+6价铬的污水会污染环境.电镀厂产生的镀铜废水中往往含有一定量的
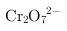 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
含
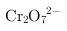 的废水
的废水
 含
含
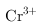 的废水
的废水
 沉淀
沉淀
①
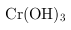 的化学性质与
的化学性质与
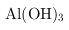 相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,用离子方程式表示其原因
相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,用离子方程式表示其原因
②下列溶液中可以代替上述流程中
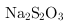 溶液的是
溶液的是
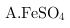 溶液 B.浓
溶液 B.浓
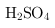 C.酸性
C.酸性
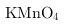 溶液
溶液
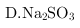 溶液
溶液
③调整溶液的
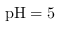 时,通过列式计算说明溶液中的
时,通过列式计算说明溶液中的
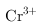 是否沉淀完全
是否沉淀完全
④上述流程中,每消耗
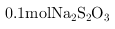 转移
转移
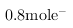 ,则加入
,则加入
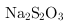 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为
题目解答
答案
解:(1)三氧化二铬与铝发生铝热反应的方程式为: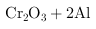
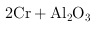 ;
;
因此,本题正确答案是: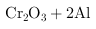
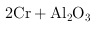 ;
;
(2)盐酸中的氯是-1价具有还原性,会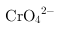 被氧化成氯气,
被氧化成氯气,
因此,本题正确答案是:盐酸中的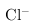 会被氧化,产生
会被氧化,产生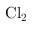 ;
;
(3)由图2可以知道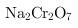 的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,
的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,
因此,本题正确答案是:蒸发结晶、趁热过滤;
(4)①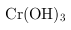 的化学性质与
的化学性质与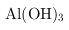 相似,如果氢氧化钠过量
相似,如果氢氧化钠过量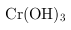 会溶解,发生离子方程式为
会溶解,发生离子方程式为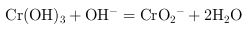 ,
,
因此,本题正确答案是: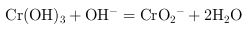 ;
;
②可以代替上述流程中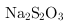 溶液,需要具有还原性,能还原重铬酸根离子;
溶液,需要具有还原性,能还原重铬酸根离子;
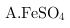 溶液中亚铁离子具有还原性,可以还原
溶液中亚铁离子具有还原性,可以还原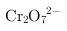 离子,但又引入新的杂质离子铁离子,故A不符合;
离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓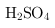 具有强氧化性,不能表现还原性,不能还原
具有强氧化性,不能表现还原性,不能还原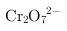 ,故B不符合;
,故B不符合;
C.酸性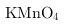 是强氧化剂不能还原
是强氧化剂不能还原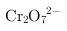 ,故C不符合;
,故C不符合;
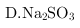 溶液中亚硫酸根离子具有还原性,可以还原
溶液中亚硫酸根离子具有还原性,可以还原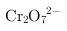 ,故D符合;
,故D符合;
因此,本题正确答案是:D;
③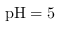 时,
时,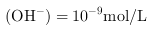 ,所以
,所以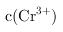 •
•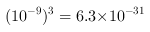 ,解之得
,解之得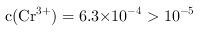 ,所以没有沉淀完全,
,所以没有沉淀完全,
因此,本题正确答案是: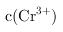 •
•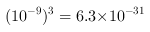 ,解之得
,解之得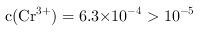 ,所以没有沉淀完全;
,所以没有沉淀完全;
④每消耗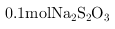 转移
转移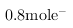 ,
,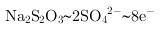 ,
,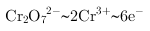 ,根据氧化还原反应电子守恒配平书写,
,根据氧化还原反应电子守恒配平书写,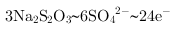 ,
,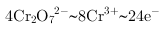 ,得到的氧化还原反应的离子方程式为
,得到的氧化还原反应的离子方程式为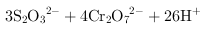 ═
═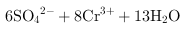 ;
;
因此,本题正确答案是: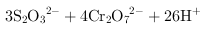 ═
═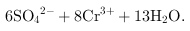
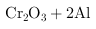
| ||
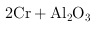 ;
; 因此,本题正确答案是:
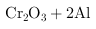
| ||
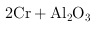 ;
; (2)盐酸中的氯是-1价具有还原性,会
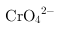 被氧化成氯气,
被氧化成氯气, 因此,本题正确答案是:盐酸中的
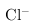 会被氧化,产生
会被氧化,产生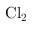 ;
; (3)由图2可以知道
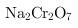 的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,
的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠, 因此,本题正确答案是:蒸发结晶、趁热过滤;
(4)①
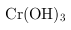 的化学性质与
的化学性质与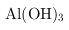 相似,如果氢氧化钠过量
相似,如果氢氧化钠过量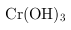 会溶解,发生离子方程式为
会溶解,发生离子方程式为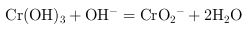 ,
, 因此,本题正确答案是:
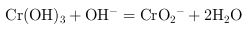 ;
; ②可以代替上述流程中
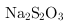 溶液,需要具有还原性,能还原重铬酸根离子;
溶液,需要具有还原性,能还原重铬酸根离子; 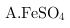 溶液中亚铁离子具有还原性,可以还原
溶液中亚铁离子具有还原性,可以还原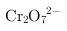 离子,但又引入新的杂质离子铁离子,故A不符合;
离子,但又引入新的杂质离子铁离子,故A不符合; B.浓
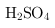 具有强氧化性,不能表现还原性,不能还原
具有强氧化性,不能表现还原性,不能还原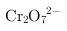 ,故B不符合;
,故B不符合; C.酸性
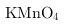 是强氧化剂不能还原
是强氧化剂不能还原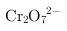 ,故C不符合;
,故C不符合;  溶液中亚硫酸根离子具有还原性,可以还原
溶液中亚硫酸根离子具有还原性,可以还原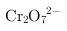 ,故D符合;
,故D符合; 因此,本题正确答案是:D;
③
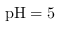 时,
时,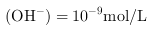 ,所以
,所以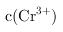 •
•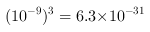 ,解之得
,解之得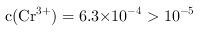 ,所以没有沉淀完全,
,所以没有沉淀完全, 因此,本题正确答案是:
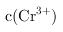 •
•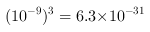 ,解之得
,解之得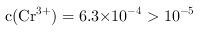 ,所以没有沉淀完全;
,所以没有沉淀完全; ④每消耗
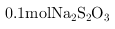 转移
转移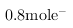 ,
,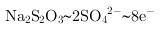 ,
,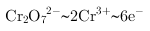 ,根据氧化还原反应电子守恒配平书写,
,根据氧化还原反应电子守恒配平书写,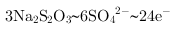 ,
,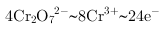 ,得到的氧化还原反应的离子方程式为
,得到的氧化还原反应的离子方程式为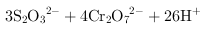 ═
═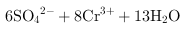 ;
; 因此,本题正确答案是:
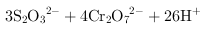 ═
═