题目
在1000K,反应_(z)+2(H)_(2)(g)=C(H)_(4)(g)的标准摩尔反应焓_(z)+2(H)_(2)(g)=C(H)_(4)(g)与温度无关,_(z)+2(H)_(2)(g)=C(H)_(4)(g)(1) 该反应在1200K、500kPa下,由H2(g)与C(石)开始反应,平衡时系统中H2(g)的分压为多少?(2) 在上述平衡系统中,恒温恒容下充入惰性气体,平衡将如何移动?为什么?
在1000K,反应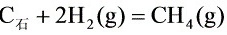 的标准摩尔反应焓
的标准摩尔反应焓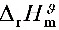 与温度无关,
与温度无关,
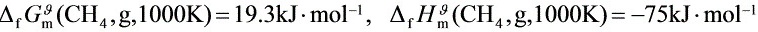
(1) 该反应在1200K、500kPa下,由H2(g)与C(石)开始反应,平衡时系统中H2(g)的分压为
多少?
(2) 在上述平衡系统中,恒温恒容下充入惰性气体,平衡将如何移动?为什么?
题目解答
答案
解: (1)
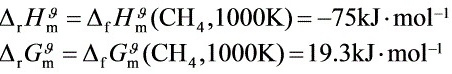
又 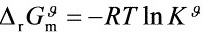
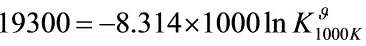
解之 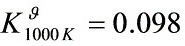
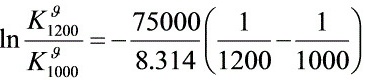
解之 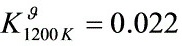
设平衡系统中H2的量分数为x ,则CH4为1-x
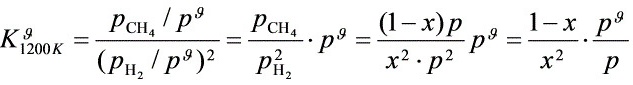
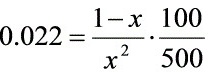 解之
解之 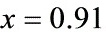
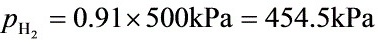
(2) 不移动
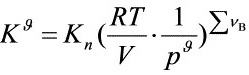
∵ 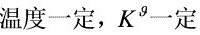
∴ 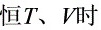 ,
,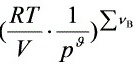 不变
不变
∴ 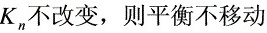 。
。
解析
步骤 1:计算1000K时的平衡常数
根据给定的${\Delta }_{r}{G}_{m}^{9}$和${\Delta }_{r}{H}_{m}^{9}$,可以计算出1000K时的平衡常数${K}_{1000K}^{9}$。使用公式${\Delta }_{r}{G}_{m}^{9}=-RT\ln K$,其中$R$是气体常数,$T$是温度,$K$是平衡常数。
步骤 2:计算1200K时的平衡常数
利用${\Delta }_{r}{H}_{m}^{9}$与温度无关的性质,通过范特霍夫方程计算1200K时的平衡常数${K}_{1200K}^{9}$。
步骤 3:计算平衡时H2(g)的分压
根据平衡常数${K}_{1200K}^{9}$,利用反应物和生成物的分压关系,计算平衡时H2(g)的分压。
步骤 4:分析恒温恒容下充入惰性气体对平衡的影响
根据勒夏特列原理,分析恒温恒容下充入惰性气体对平衡的影响。
根据给定的${\Delta }_{r}{G}_{m}^{9}$和${\Delta }_{r}{H}_{m}^{9}$,可以计算出1000K时的平衡常数${K}_{1000K}^{9}$。使用公式${\Delta }_{r}{G}_{m}^{9}=-RT\ln K$,其中$R$是气体常数,$T$是温度,$K$是平衡常数。
步骤 2:计算1200K时的平衡常数
利用${\Delta }_{r}{H}_{m}^{9}$与温度无关的性质,通过范特霍夫方程计算1200K时的平衡常数${K}_{1200K}^{9}$。
步骤 3:计算平衡时H2(g)的分压
根据平衡常数${K}_{1200K}^{9}$,利用反应物和生成物的分压关系,计算平衡时H2(g)的分压。
步骤 4:分析恒温恒容下充入惰性气体对平衡的影响
根据勒夏特列原理,分析恒温恒容下充入惰性气体对平衡的影响。