题目
含Fe2O3和Al2O3试样0.2015g,溶解后在pH=2.0时以磺基水杨酸为指示剂,加热至50℃左右,以0.02008mol·L−1 EDTA滴定至红色消失,消耗EDTA标液15.20mL,然后加入上述EDTA标液25.00mL,加热煮沸,调节pH=4.5,以PAN为指示剂,趁热用0.02112mol·L−1 Cu2+标液返滴定,用去8.16mL,计算试样中Fe2O3和Al2O3的质量分数。已知M(Fe2O3) = 159.69 g·mol−1,M(Al2O3) = 101.96 g·mol−1。
含Fe2O3和Al2O3试样0.2015g,溶解后在pH=2.0时以磺基水杨酸为指示剂,加热至50℃左右,以0.02008mol·L−1 EDTA滴定至红色消失,消耗EDTA标液15.20mL,然后加入上述EDTA标液25.00mL,加热煮沸,调节pH=4.5,以PAN为指示剂,趁热用0.02112mol·L−1 Cu2+标液返滴定,用去8.16mL,计算试样中Fe2O3和Al2O3的质量分数。已知M(Fe2O3) = 159.69 g·mol−1,M(Al2O3) = 101.96 g·mol−1。
题目解答
答案
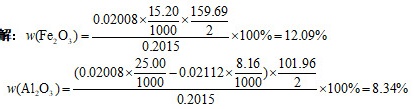
解析
步骤 1:计算Fe2O3的摩尔数
在pH=2.0时,EDTA滴定Fe3+,消耗EDTA标液15.20mL,计算Fe3+的摩尔数。
步骤 2:计算Al2O3的摩尔数
在pH=4.5时,EDTA滴定Al3+,加入EDTA标液25.00mL,用Cu2+标液返滴定,用去8.16mL,计算Al3+的摩尔数。
步骤 3:计算Fe2O3和Al2O3的质量分数
根据Fe2O3和Al2O3的摩尔数,计算它们的质量分数。
在pH=2.0时,EDTA滴定Fe3+,消耗EDTA标液15.20mL,计算Fe3+的摩尔数。
步骤 2:计算Al2O3的摩尔数
在pH=4.5时,EDTA滴定Al3+,加入EDTA标液25.00mL,用Cu2+标液返滴定,用去8.16mL,计算Al3+的摩尔数。
步骤 3:计算Fe2O3和Al2O3的质量分数
根据Fe2O3和Al2O3的摩尔数,计算它们的质量分数。