题目
丙烯是重要的化工原料,利用丙烷制备丙烯通常有三种方法。方法一:丙烷直接脱氢法(1)丙烷直接脱氢的主要反应为C3H8(g)⇌C3H6(g)+H2(g),△H1=+129.80kJ•mol-1。600℃、0.4MPa下,向装有催化剂的恒压密闭容器中以((n({{H_2)O})})/((n({{C_3){H_8)})}}=1投料,发生反应。丙烷的转化率(α)随时间(t)变化的曲线如图所示。α/%-|||-59-|||-40-|||-30-|||-20-|||-10--|||-0 t/h-|||-/2①该体系达到平衡状态的标志为 ____ 。(填选项字母)A.单位时间内,消耗C3H8(g)的物质的量等于生成H2(g)的物质的量B.体系中气体的密度不再改变C.单位体积内气体的分子数不再改变D.H2O(g)的分压不再改变②用分压表示该反应的平衡常数Kp= ____ ;增大((n({{H_2)O})})/((n({{C_3){H_8)})}}的值可提高丙烷的平衡转化率,解释其原因为 ____ 。方法二:丙烷氧化脱氢法(2)丙烷氧化脱氢制丙烯时,主要发生反应C3H8 (g)+(1)/(2)O2(g)⇌C3H6(g)+H2O(g)△H2。已知:氢气的燃烧热(△H)为-285.5kJ•mol-1;水的汽化热(△H)为+40.8kJ•mol-1;结合△H1,可计算△H2= ____ ;与方法一相比,方法二的优点为 ____ 。(写出一点即可)(3)我国科研机构利用计算机模拟得出:在VO3/CeO2表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图所示),其中TSTebbe表示过渡态。由图分析可知,丙烷氧化脱去的第一个H是与 ____ (填“VO3”或“CeO2”)中的O结合,原因为 ____ 。α/%-|||-59-|||-40-|||-30-|||-20-|||-10--|||-0 t/h-|||-/2方法三:丙烷与CO2耦合法(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:ⅰ.C3H8(g)⇌C3H6(g)+H2(g)ⅱ.C3H8(g)⇌C2H4(g)+CH4(g)ⅲ.3CO2(g)+9H2(g)⇌C3H6(g)+6H2O(g)ⅳ.CO2(g)+H2(g)⇌CO(g)+H2O(g)在580℃时,将C3H8和CO2按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图(a)和(b)所示。已知:C3H6的选择性越高,副产物的含量越低。耦合法制丙烯适宜选择的生产条件为 ____ ;随压强增大C3H6(g)的平衡产率先增大后减小的原因为 ____ 。α/%-|||-59-|||-40-|||-30-|||-20-|||-10--|||-0 t/h-|||-/2
丙烯是重要的化工原料,利用丙烷制备丙烯通常有三种方法。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为C3H8(g)⇌C3H6(g)+H2(g),△H1=+129.80kJ•mol-1。600℃、0.4MPa下,向装有催化剂的恒压密闭容器中以$\frac{{n({{H_2}O})}}{{n({{C_3}{H_8}})}}$=1投料,发生反应。丙烷的转化率(α)随时间(t)变化的曲线如图所示。
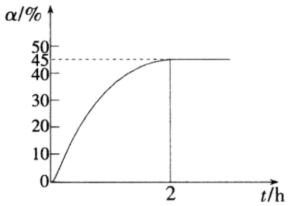
①该体系达到平衡状态的标志为 ____ 。(填选项字母)
A.单位时间内,消耗C3H8(g)的物质的量等于生成H2(g)的物质的量
B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D.H2O(g)的分压不再改变
②用分压表示该反应的平衡常数Kp= ____ ;增大$\frac{{n({{H_2}O})}}{{n({{C_3}{H_8}})}}$的值可提高丙烷的平衡转化率,解释其原因为 ____ 。
方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应C3H8 (g)+$\frac{1}{2}$O2(g)⇌C3H6(g)+H2O(g)△H2。已知:氢气的燃烧热(△H)为-285.5kJ•mol-1;水的汽化热(△H)为+40.8kJ•mol-1;结合△H1,可计算△H2= ____ ;与方法一相比,方法二的优点为 ____ 。(写出一点即可)
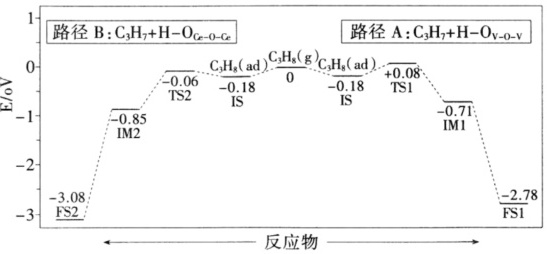
(3)我国科研机构利用计算机模拟得出:在VO3/CeO2表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图所示),其中TSTebbe表示过渡态。由图分析可知,丙烷氧化脱去的第一个H是与 ____ (填“VO3”或“CeO2”)中的O结合,原因为 ____ 。
方法三:丙烷与CO2耦合法
(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:
ⅰ.C3H8(g)⇌C3H6(g)+H2(g)
ⅱ.C3H8(g)⇌C2H4(g)+CH4(g)
ⅲ.3CO2(g)+9H2(g)⇌C3H6(g)+6H2O(g)
ⅳ.CO2(g)+H2(g)⇌CO(g)+H2O(g)
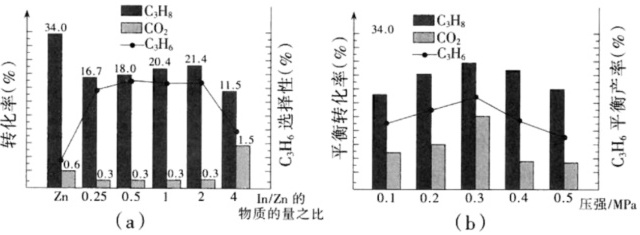
在580℃时,将C3H8和CO2按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图(a)和(b)所示。
已知:C3H6的选择性越高,副产物的含量越低。耦合法制丙烯适宜选择的生产条件为 ____ ;随压强增大C3H6(g)的平衡产率先增大后减小的原因为 ____ 。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为C3H8(g)⇌C3H6(g)+H2(g),△H1=+129.80kJ•mol-1。600℃、0.4MPa下,向装有催化剂的恒压密闭容器中以$\frac{{n({{H_2}O})}}{{n({{C_3}{H_8}})}}$=1投料,发生反应。丙烷的转化率(α)随时间(t)变化的曲线如图所示。

①该体系达到平衡状态的标志为 ____ 。(填选项字母)
A.单位时间内,消耗C3H8(g)的物质的量等于生成H2(g)的物质的量
B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D.H2O(g)的分压不再改变
②用分压表示该反应的平衡常数Kp= ____ ;增大$\frac{{n({{H_2}O})}}{{n({{C_3}{H_8}})}}$的值可提高丙烷的平衡转化率,解释其原因为 ____ 。
方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应C3H8 (g)+$\frac{1}{2}$O2(g)⇌C3H6(g)+H2O(g)△H2。已知:氢气的燃烧热(△H)为-285.5kJ•mol-1;水的汽化热(△H)为+40.8kJ•mol-1;结合△H1,可计算△H2= ____ ;与方法一相比,方法二的优点为 ____ 。(写出一点即可)
(3)我国科研机构利用计算机模拟得出:在VO3/CeO2表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图所示),其中TSTebbe表示过渡态。由图分析可知,丙烷氧化脱去的第一个H是与 ____ (填“VO3”或“CeO2”)中的O结合,原因为 ____ 。

方法三:丙烷与CO2耦合法
(4)丙烷与CO2耦合法制丙烯时,主要发生如下反应:
ⅰ.C3H8(g)⇌C3H6(g)+H2(g)
ⅱ.C3H8(g)⇌C2H4(g)+CH4(g)
ⅲ.3CO2(g)+9H2(g)⇌C3H6(g)+6H2O(g)
ⅳ.CO2(g)+H2(g)⇌CO(g)+H2O(g)
在580℃时,将C3H8和CO2按体积比为1:1充入一恒压密闭容器中进行反应,实验测得体系中C3H8(g)、的转化率和C3H6(g)的选择性、C3H6(g)的产率随催化剂组成和压强的变化分别如图(a)和(b)所示。
已知:C3H6的选择性越高,副产物的含量越低。耦合法制丙烯适宜选择的生产条件为 ____ ;随压强增大C3H6(g)的平衡产率先增大后减小的原因为 ____ 。

题目解答
答案
解:(1)①A.随着反应的进行,消耗C3H8(g)的物质的量始终等于生成H2(g)的物质的量,所以不能作为平衡状态的标志,故A错误;
B.随着反应的进行,容器的体积逐渐变大,气体质量不变,故密度逐渐减小,平衡后,体积不变,密度不变,故可以作为判断依据,故B正确;
C.随着反应进行,根据理想气体的状态方程PV=nRT,当温度和压强不再改变时,单位体积内的物质的量不会发生变化,故C错误;
D.气体的物质的量在一直变化,水的物质的量不变,体积分数一直发生变化,所以分压一直在变化,平衡后分压不变,故D正确;
故答案为:BD;
②设起始投入的丙烷和水的物质的量均为1mol,从图象可知,丙烷平衡转化率为0.45,
C3H8(g)=C3H6(g)+H2(g) (单位:mol)
起始量:1 0 0
转化量:0.45 0.45 0.45
平衡量:0.55 0.45 0.45
故平衡后的总物质的量为(1+0.55+0.45+0.45)mol=2.45mol,p(H2)=p(C3H6)=0.4×$\frac{0.45}{2.45}$MPa,p(C3H8)=0.4×$\frac{0.55}{2.45}$MPa,所以Kp=$\frac{p(C{}_{3}{H}_{6})×p({H}_{2})}{p({C}_{3}H{}_{8})}$MPa=0.06MPa,恒压情况下,该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向进行,
故答案为:0.06MPa;该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向进行;
(2)已知氢气的燃烧热为-285.5kJ/mol;水的汽化热为+40.8,故存在热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.5kJ/mol,H2O(l)=H2O(g)△H4=+40.8kJ/mol,C3H8(g)⇌C3H6(g)+H2(g),△H1=+129.80kJ•mol-1,△H2=△H1+△H4+△H3=-114.9kJ•mol-1,方法一为吸热反应,方法二为放热反应,所以与反应一相比,反应二能降低能耗,有利于丙烷转化成丙烯,
故答案为:-114.9kJ•mol-1;使丙烷转化为丙烯的倾向变大;
(3)由图象可知,途径B的反应活化能更低,反应速率快,所以丙烷氧化脱去的第一个H是与CeO2结合,
故答案为:CeO2;路径B的活化能低,反应速率快;
(4)由图象可知,在In/Zn的物质的量之比为2、压强为0.3 MPa时平衡转化率最大,在C3H8(g)⇌C3H6(g)+H2(g)中丙烷为生成物,随着压强的增大,平衡逆向移动,产率降低;在3CO2(g)+9H2(g)⇌C3H6(g)+6H2O(g)中,随着压强的增大,平衡正向移动,丙烯的产率增加,故随着压强增大,丙烯的平衡产率先增大后减小的原因为:压强低于 0.3 MPa时,压强增大反应ⅲ平衡正向移动,丙烯产率增大;压强高于 0.3 MPa时,压强增大反应i平衡逆向移动,丙烯产率减小,
故答案为:压强低于 0.3 MPa时,压强增大反应ⅲ平衡正向移动,丙烯产率增大;压强高于 0.3 MPa时,压强增大反应i平衡逆向移动,丙烯产率减小。
B.随着反应的进行,容器的体积逐渐变大,气体质量不变,故密度逐渐减小,平衡后,体积不变,密度不变,故可以作为判断依据,故B正确;
C.随着反应进行,根据理想气体的状态方程PV=nRT,当温度和压强不再改变时,单位体积内的物质的量不会发生变化,故C错误;
D.气体的物质的量在一直变化,水的物质的量不变,体积分数一直发生变化,所以分压一直在变化,平衡后分压不变,故D正确;
故答案为:BD;
②设起始投入的丙烷和水的物质的量均为1mol,从图象可知,丙烷平衡转化率为0.45,
C3H8(g)=C3H6(g)+H2(g) (单位:mol)
起始量:1 0 0
转化量:0.45 0.45 0.45
平衡量:0.55 0.45 0.45
故平衡后的总物质的量为(1+0.55+0.45+0.45)mol=2.45mol,p(H2)=p(C3H6)=0.4×$\frac{0.45}{2.45}$MPa,p(C3H8)=0.4×$\frac{0.55}{2.45}$MPa,所以Kp=$\frac{p(C{}_{3}{H}_{6})×p({H}_{2})}{p({C}_{3}H{}_{8})}$MPa=0.06MPa,恒压情况下,该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向进行,
故答案为:0.06MPa;该反应为气体分子数增加的反应,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向进行;
(2)已知氢气的燃烧热为-285.5kJ/mol;水的汽化热为+40.8,故存在热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.5kJ/mol,H2O(l)=H2O(g)△H4=+40.8kJ/mol,C3H8(g)⇌C3H6(g)+H2(g),△H1=+129.80kJ•mol-1,△H2=△H1+△H4+△H3=-114.9kJ•mol-1,方法一为吸热反应,方法二为放热反应,所以与反应一相比,反应二能降低能耗,有利于丙烷转化成丙烯,
故答案为:-114.9kJ•mol-1;使丙烷转化为丙烯的倾向变大;
(3)由图象可知,途径B的反应活化能更低,反应速率快,所以丙烷氧化脱去的第一个H是与CeO2结合,
故答案为:CeO2;路径B的活化能低,反应速率快;
(4)由图象可知,在In/Zn的物质的量之比为2、压强为0.3 MPa时平衡转化率最大,在C3H8(g)⇌C3H6(g)+H2(g)中丙烷为生成物,随着压强的增大,平衡逆向移动,产率降低;在3CO2(g)+9H2(g)⇌C3H6(g)+6H2O(g)中,随着压强的增大,平衡正向移动,丙烯的产率增加,故随着压强增大,丙烯的平衡产率先增大后减小的原因为:压强低于 0.3 MPa时,压强增大反应ⅲ平衡正向移动,丙烯产率增大;压强高于 0.3 MPa时,压强增大反应i平衡逆向移动,丙烯产率减小,
故答案为:压强低于 0.3 MPa时,压强增大反应ⅲ平衡正向移动,丙烯产率增大;压强高于 0.3 MPa时,压强增大反应i平衡逆向移动,丙烯产率减小。