题目
已知: varphi ((R)_(2)|(Cl)^-)=1.36V (varphi )^theta ((O)_(2)|(OH)^-)=0.401V (varphi )^theta ((Cu)^2+|Cu)=0.337V,-|||-用铜电极电解CuCl2的水溶液,在阳极上会发生 ()A.析出氯气B.析出铜C.析出氧气D.铜电极溶解
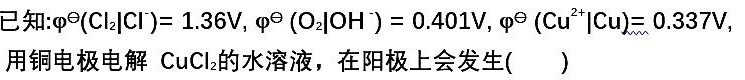
- A.析出氯气
- B.析出铜
- C.析出氧气
- D.铜电极溶解
题目解答
答案
D. 铜电极溶解
解析
步骤 1:确定电极反应
在电解CuCl2的水溶液时,阳极上发生的反应是铜电极失去电子,即铜被氧化。根据给定的电极电势,${\varphi }^{\theta }({Cu}^{2+}|Cu)=0.337V$,表示铜离子在标准状态下氧化铜的电势。
步骤 2:比较电极电势
在阳极上,铜电极的氧化电势为0.337V,而析出氯气的电势为1.36V,析出氧气的电势为0.401V。由于铜电极的氧化电势低于析出氯气和氧气的电势,因此在阳极上铜电极会优先失去电子,即铜电极溶解。
步骤 3:确定阳极反应
根据上述分析,阳极上发生的反应是铜电极溶解,即铜失去电子变成铜离子进入溶液中。
在电解CuCl2的水溶液时,阳极上发生的反应是铜电极失去电子,即铜被氧化。根据给定的电极电势,${\varphi }^{\theta }({Cu}^{2+}|Cu)=0.337V$,表示铜离子在标准状态下氧化铜的电势。
步骤 2:比较电极电势
在阳极上,铜电极的氧化电势为0.337V,而析出氯气的电势为1.36V,析出氧气的电势为0.401V。由于铜电极的氧化电势低于析出氯气和氧气的电势,因此在阳极上铜电极会优先失去电子,即铜电极溶解。
步骤 3:确定阳极反应
根据上述分析,阳极上发生的反应是铜电极溶解,即铜失去电子变成铜离子进入溶液中。