题目
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:(1)I2的一种制备方法如图所示:A gNO3 Fe粉 Cl2-|||-净化除氯后-|||-含https:/img.zuoyebang.cc/zyb_265be9cc5ba99a0b70410c5edf02b513.jpgdiv 富集 悬浊液 转化 氧化 +I2-|||-沉淀①加入Fe粉进行转化反应的离子方程式为 ____ ,生成的沉淀与硝酸反应,生成 ____ 后可循环使用。②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为 ____ ;若反应物用量比n(Cl2)n(FeI2)=1.5时,氧化产物为 ____ ;当n(Cl2)n(FeI2)>1.5后,单质碘的收率会降低,原因是 ____ 。(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为 ____ 。(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1mol I2,消耗的KI至少为 ____ mol。I2在KI溶液中可发生反应:I2+I-⇌I3-。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是 ____ 。
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图所示:
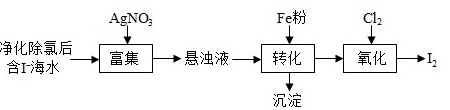
①加入Fe粉进行转化反应的离子方程式为 ____ ,生成的沉淀与硝酸反应,生成 ____ 后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为 ____ ;若反应物用量比
=1.5时,氧化产物为 ____ ;当
>1.5后,单质碘的收率会降低,原因是 ____ 。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为 ____ 。
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1mol I2,消耗的KI至少为 ____ mol。I2在KI溶液中可发生反应:I2+I-⇌I3-。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是 ____ 。
(1)I2的一种制备方法如图所示:

①加入Fe粉进行转化反应的离子方程式为 ____ ,生成的沉淀与硝酸反应,生成 ____ 后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为 ____ ;若反应物用量比
| n(Cl2) |
| n(FeI2) |
| n(Cl2) |
| n(FeI2) |
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为 ____ 。
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1mol I2,消耗的KI至少为 ____ mol。I2在KI溶液中可发生反应:I2+I-⇌I3-。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是 ____ 。
题目解答
答案
Fe+2AgI=2I-+2Ag+Fe2+,硝酸银,Cl2+FeI2=FeCl2+I2,FeCl3、I2,过量的氯气继续氧化I2,导致碘的回收率降低,2IO3-+5HSO3-=5SO42-+3H++H2O+I2,4,保证所有的Cu2+充分还原为CuI,保证I₂完全溶解,从而与CuI充分分离
解析
步骤 1:Fe粉转化反应
Fe粉与AgI反应生成I^{-}和Fe^{2+},同时生成Ag沉淀。
步骤 2:Cl_2氧化反应
Cl_2氧化FeI_2生成FeCl_2和I_2,当n(Cl2)/n(FeI2)>1.5时,Cl_2继续氧化I_2,导致碘的回收率降低。
步骤 3:NaIO_3制备I_2
NaIO_3与NaHSO_3反应生成I_2,总反应为2IO_3^{-}+5HSO_3^{-}=5SO_4^{2-}+3H^{+}+H_2O+I_2。
步骤 4:KI与CuSO_4反应
KI与CuSO_4反应生成CuI沉淀和I_2,生成1mol I_2需要4mol KI。
步骤 5:KI过量原因
过量的KI保证Cu^{2+}充分还原为CuI,同时保证I₂完全溶解,从而与CuI充分分离。
Fe粉与AgI反应生成I^{-}和Fe^{2+},同时生成Ag沉淀。
步骤 2:Cl_2氧化反应
Cl_2氧化FeI_2生成FeCl_2和I_2,当n(Cl2)/n(FeI2)>1.5时,Cl_2继续氧化I_2,导致碘的回收率降低。
步骤 3:NaIO_3制备I_2
NaIO_3与NaHSO_3反应生成I_2,总反应为2IO_3^{-}+5HSO_3^{-}=5SO_4^{2-}+3H^{+}+H_2O+I_2。
步骤 4:KI与CuSO_4反应
KI与CuSO_4反应生成CuI沉淀和I_2,生成1mol I_2需要4mol KI。
步骤 5:KI过量原因
过量的KI保证Cu^{2+}充分还原为CuI,同时保证I₂完全溶解,从而与CuI充分分离。