题目
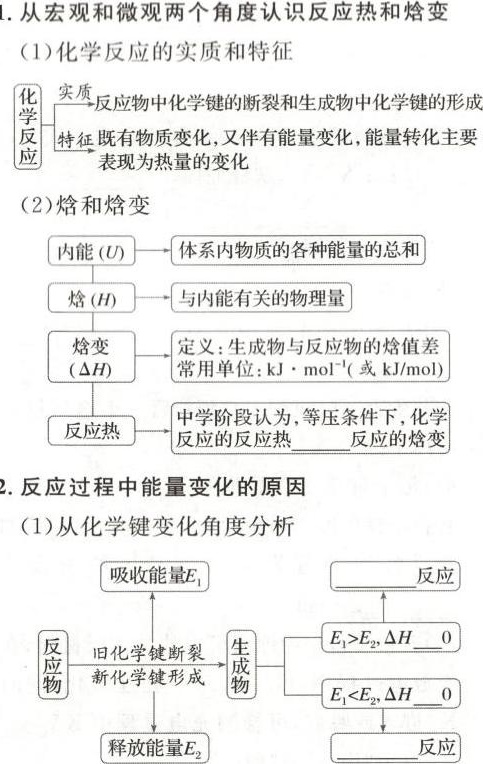
1.从宏观和微观两个角度认识反应热和焓变-|||-(1)化学反应的实质和特征-|||-实质 反应物中化学键的断裂和生成物中化学键的形成-|||-特征既有物质变化,又伴有能量变化,能量转化主要-|||-表现为热量的变化-|||-(2)焓和焓变-|||-内能(U) 体系内物质的各种能量的总和-|||-焓(H) □ 与内能有关的物理量-|||-焓变 定义:生成物与反应物的焓值差-|||-(Delta HD 常用单位: cdot (mol)^-1 或 kJ/mol)-|||-反应热 中学阶段认为,等压条件下,化学-|||-反应的反应热 __ 反应的焓变-|||-2.反应过程中能量变化的原因-|||-(1)从化学键变化角度分析-|||-吸收能量E1 __ 反应-|||-蠡 旧化学键断裂 囊 _(1)gt (E)_(2), Delta H __ 0-|||-新化学键形成-|||-_(1)lt (E)_(2), Delta H __ 0-|||-释放能量E2 __ 反应1.从宏观和微观两个角度认识反应热和焓变-|||-(1)化学反应的实质和特征-|||-实质 反应物中化学键的断裂和生成物中化学键的形成-|||-特征既有物质变化,又伴有能量变化,能量转化主要-|||-表现为热量的变化-|||-(2)焓和焓变-|||-内能(U) 体系内物质的各种能量的总和-|||-焓(H) □ 与内能有关的物理量-|||-焓变 定义:生成物与反应物的焓值差-|||-(Delta HD 常用单位: cdot (mol)^-1 或 kJ/mol)-|||-反应热 中学阶段认为,等压条件下,化学-|||-反应的反应热 __ 反应的焓变-|||-2.反应过程中能量变化的原因-|||-(1)从化学键变化角度分析-|||-吸收能量E1 __ 反应-|||-蠡 旧化学键断裂 囊 _(1)gt (E)_(2), Delta H __ 0-|||-新化学键形成-|||-_(1)lt (E)_(2), Delta H __ 0-|||-释放能量E2 __ 反应1.从宏观和微观两个角度认识反应热和焓变-|||-(1)化学反应的实质和特征-|||-实质 反应物中化学键的断裂和生成物中化学键的形成-|||-特征既有物质变化,又伴有能量变化,能量转化主要-|||-表现为热量的变化-|||-(2)焓和焓变-|||-内能(U) 体系内物质的各种能量的总和-|||-焓(H) □ 与内能有关的物理量-|||-焓变 定义:生成物与反应物的焓值差-|||-(Delta HD 常用单位: cdot (mol)^-1 或 kJ/mol)-|||-反应热 中学阶段认为,等压条件下,化学-|||-反应的反应热 __ 反应的焓变-|||-2.反应过程中能量变化的原因-|||-(1)从化学键变化角度分析-|||-吸收能量E1 __ 反应-|||-蠡 旧化学键断裂 囊 _(1)gt (E)_(2), Delta H __ 0-|||-新化学键形成-|||-_(1)lt (E)_(2), Delta H __ 0-|||-释放能量E2 __ 反应


题目解答
答案

解析
考查要点:本题主要考查化学反应中能量变化的宏观与微观理解,焓变与反应热的关系,以及常见吸热、放热反应的判断。
解题核心:
- 宏观角度:等压条件下,反应热等于焓变($\Delta H$)。
- 微观角度:化学键断裂吸收的能量($E_1$)与形成释放的能量($E_2$)的比较决定反应是吸热还是放热。
- 反应类型判断:需熟记常见吸热、放热反应的分类标准,特别注意特殊案例(如吸热的化合反应)。
1. (2) 焓变与反应热的关系
关键结论:在等压条件下,化学反应的反应热 等于 反应的焓变($\Delta H$)。
推导:
- 宏观上,反应热是化学反应中能量变化的直接体现。
- 焓变($\Delta H$)是生成物与反应物的焓值差,等压条件下二者数值相等。
2. (1) 能量变化与化学键的关系
吸热与放热的判断:
- 吸热反应:旧化学键断裂吸收的能量($E_1$)大于新化学键形成释放的能量($E_2$),即 $E_1 > E_2$,此时 $\Delta H > 0$。
- 放热反应:旧化学键断裂吸收的能量($E_1$)小于新化学键形成释放的能量($E_2$),即 $E_1 < E_2$,此时 $\Delta H < 0$。
3. (3) 常见吸热、放热反应的分类
分类标准:
- 放热反应:
③大多数化合反应(如燃烧、中和反应)、⑥中和反应、⑦可燃物燃烧、⑧金属与酸反应、⑨铝热反应。 - 吸热反应:
①Ba(OH)₂·8H₂O与NH₄Cl反应、②大多数分解反应、④盐类水解、⑤C与H₂O(g)或CO₂反应。
特殊说明: - ③中的化合反应如C与CO₂高温生成CO是吸热反应,需单独记忆。