题目
已知25°C时下列电池25°C的25°C ,0.1 mol﹒kg-1 HCl的25°C⑴写出电池的电池反应;⑵求电池的电动势E。
已知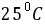 时下列电池
时下列电池
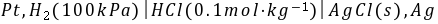 的
的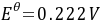 ,
,
0.1 mol﹒kg-1 HCl的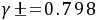
⑴写出电池的电池反应;
⑵求电池的电动势E。
题目解答
答案
解:⑴电池反应: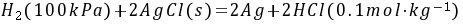
⑵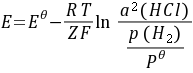
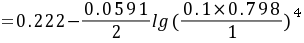
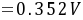
解析
本题主要考查原电池电池反应的书写以及能斯特方程的应用。解题思路如下:
- 书写电池反应:根据原电池的组成,分别确定正负极发生的反应,然后将正负极反应相加得到电池反应。
- 计算电池电动势:利用能斯特方程$E = E^{\theta}-\frac{RT}{ZF}\ln Q$来计算电池的电动势,其中$E^{\theta}$是标准电动势,$R$是气体常数,$T$是温度,$Z$是电池反应中转移的电子数,$F$是法拉第常数,$Q$是反应商。
(1)书写电池反应
- 负极反应:在原电池中,负极发生氧化反应。对于$Pt,H_2(100kPa)$电极,氢气失去电子被氧化,电极反应式为$H_2(g)\to 2H^+(aq)+2e^-$。
- 正极反应:正极发生还原反应。对于$AgCl(s),Ag$电极,$AgCl$得到电子被还原为$Ag$和$Cl^-$,电极反应式为$2AgCl(s)+2e^-\to 2Ag(s)+2Cl^-(aq)$。
- 电池反应:将正负极反应相加,消去电子,得到电池反应为$H_2(100kPa)+2AgCl(s)=2Ag(s)+2HCl(0.1mol\cdot kg^{-1})$。
(2)计算电池电动势
- 确定能斯特方程:对于电池反应$H_2(100kPa)+2AgCl(s)=2Ag(s)+2HCl(0.1mol\cdot kg^{-1})$,其能斯特方程为$E = E^{\theta}-\frac{RT}{ZF}\ln Q$。
- 计算反应商$Q$:反应商$Q$是产物活度的幂之积与反应物活度的幂之积的比值。在本题中,$H_2$的活度近似为其分压$p(H_2)$,$HCl$的活度$a(HCl)=a(H^+)\cdot a(Cl^-)$,由于$HCl$完全电离,$a(H^+)=a(Cl^-)= \gamma_{\pm}m$($\gamma_{\pm}$是离子平均活度系数,$m$是质量摩尔浓度),所以$a(HCl)=(\gamma_{\pm}m)^2$。则反应商$Q=\frac{a^2(HCl)}{p(H_2)}$。
- 代入数据计算:已知$E^{\theta}=0.222V$,$T = 25^{\circ}C=(25 + 273.15)K = 298.15K$,$Z = 2$,$R = 8.314J\cdot mol^{-1}\cdot K^{-1}$,$F = 96485C\cdot mol^{-1}$,$\gamma_{\pm}=0.798$,$m = 0.1mol\cdot kg^{-1}$,$p(H_2)=100kPa$。
将$\frac{RT}{F}$在$25^{\circ}C$时近似为$0.0591V$,代入能斯特方程可得:
$\begin{align*}E&=E^{\theta}-\frac{RT}{ZF}\ln Q\\&=0.222-\frac{0.0591}{2}\lg\frac{(\gamma_{\pm}m)^4}{p(H_2)}\\&=0.222-\frac{0.0591}{2}\lg(\frac{0.1\times 0.798}{1})^4\\&=0.222-\frac{0.0591}{2}\times4\lg(0.1\times 0.798)\\&=0.222 - 0.1182\times(\lg0.1+\lg0.798)\\&=0.222 - 0.1182\times(-1 - 0.100)\\&=0.222 - 0.1182\times(-1.100)\\&=0.222 + 0.1299\\&= 0.352V\end{align*}$