题目
1、(2023湖南)常温下,用浓度为0.0200mol·T -1的NaOH标准溶液滴定浓度均为0.0200molT -1的HCI和CHCOOH的混合溶液,滴定过程中溶液的pH随T -1的变化曲线如图所示。下列说法错误的是()。T -1A.T -1B.T -1C.T -1D.T -1
1、(2023湖南)常温下,用浓度为0.0200mol·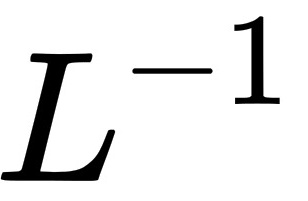 的NaOH标准溶液滴定浓度均为0.0200mol
的NaOH标准溶液滴定浓度均为0.0200mol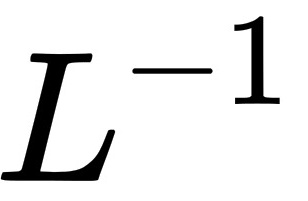 的HCI和CHCOOH的混合溶液,滴定
的HCI和CHCOOH的混合溶液,滴定
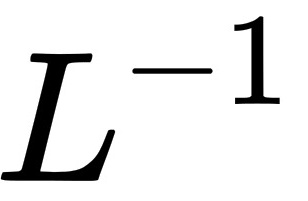 的NaOH标准溶液滴定浓度均为0.0200mol
的NaOH标准溶液滴定浓度均为0.0200mol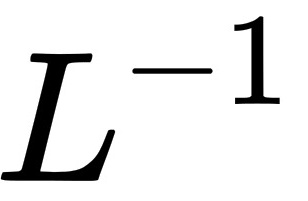 的HCI和CHCOOH的混合溶液,滴定
的HCI和CHCOOH的混合溶液,滴定过程中溶液的pH随 的变化曲线如图所示。下列说法错误的是()。
的变化曲线如图所示。下列说法错误的是()。
 的变化曲线如图所示。下列说法错误的是()。
的变化曲线如图所示。下列说法错误的是()。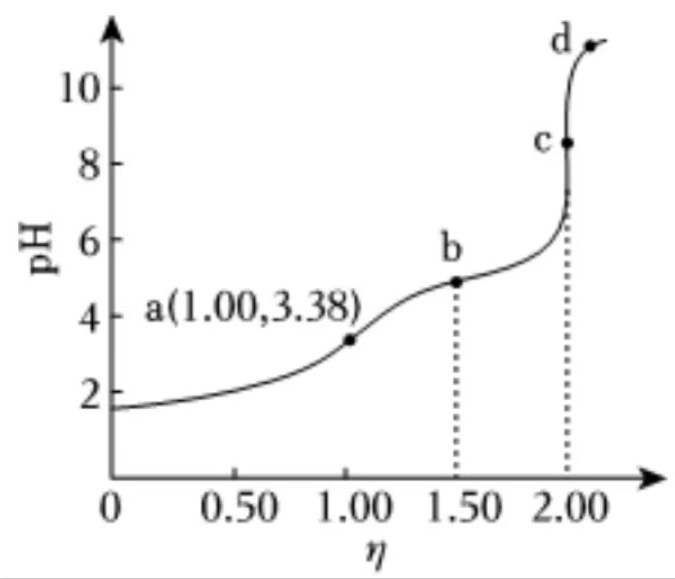
- A.

- B.
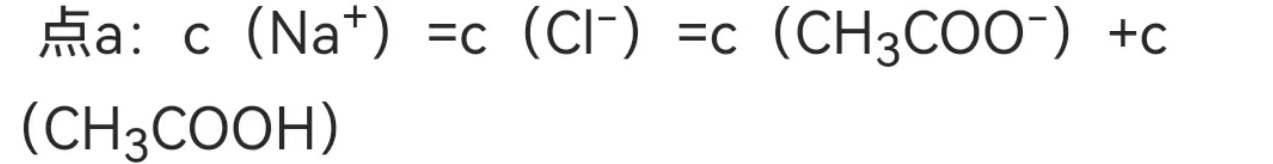
- C.
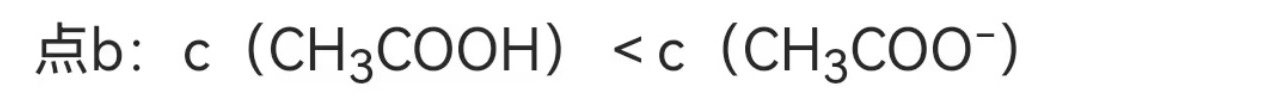
- D.
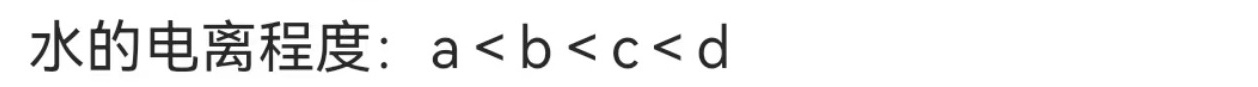
题目解答
答案
D
解析
步骤 1:分析Ka(CH3COOH)的计算
根据图中点a的pH值为3.38,可以计算出Ka(CH3COOH)的值。由于pH = -log[H+],则[H+] = 10^(-pH) = 10^(-3.38)。Ka = [H+][CH3COO-]/[CH3COOH],由于[CH3COO-] = [H+],则Ka = [H+]^2/[CH3COOH]。由于[CH3COOH] = 0.0200mol/L,可以计算出Ka = 10^(-3.38)^2/0.0200 = 10^(-4.76)。
步骤 2:分析点a的离子浓度关系
在点a,NaOH与HCl完全反应,生成NaCl,此时Na+和Cl-的浓度相等。同时,CH3COOH部分电离,生成CH3COO-和H+,因此c(Na+) = c(Cl-) = c(CH3COO-) + c(CH3COOH)。
步骤 3:分析点b的离子浓度关系
在点b,NaOH与CH3COOH完全反应,生成CH3COONa,此时CH3COO-的浓度大于CH3COOH的浓度,因此c(CH3COOH) < c(CH3COO-)。
步骤 4:分析水的电离程度
在点a,由于HCl的存在,水的电离受到抑制,电离程度最小。在点b,由于CH3COONa的存在,水的电离程度增加。在点c,由于NaOH的存在,水的电离程度进一步增加。在点d,由于NaOH过量,水的电离程度最大。
根据图中点a的pH值为3.38,可以计算出Ka(CH3COOH)的值。由于pH = -log[H+],则[H+] = 10^(-pH) = 10^(-3.38)。Ka = [H+][CH3COO-]/[CH3COOH],由于[CH3COO-] = [H+],则Ka = [H+]^2/[CH3COOH]。由于[CH3COOH] = 0.0200mol/L,可以计算出Ka = 10^(-3.38)^2/0.0200 = 10^(-4.76)。
步骤 2:分析点a的离子浓度关系
在点a,NaOH与HCl完全反应,生成NaCl,此时Na+和Cl-的浓度相等。同时,CH3COOH部分电离,生成CH3COO-和H+,因此c(Na+) = c(Cl-) = c(CH3COO-) + c(CH3COOH)。
步骤 3:分析点b的离子浓度关系
在点b,NaOH与CH3COOH完全反应,生成CH3COONa,此时CH3COO-的浓度大于CH3COOH的浓度,因此c(CH3COOH) < c(CH3COO-)。
步骤 4:分析水的电离程度
在点a,由于HCl的存在,水的电离受到抑制,电离程度最小。在点b,由于CH3COONa的存在,水的电离程度增加。在点c,由于NaOH的存在,水的电离程度进一步增加。在点d,由于NaOH过量,水的电离程度最大。