题目
↑CO、Fe的质量 /g-|||-m-|||-8.4-|||-0 13.2-|||-CO2的质量/g将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全,反应过程中容器内部分物质的质量变化如图所示,下列说法正确的是( )A. m=12.6B. 当CO2为8.8g时,CO的质量为11.2gC. 参加反应的铁的氧化物的质量为16gD. 铁的氧化物中x:y=2:3
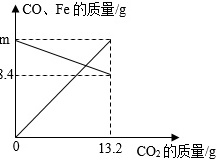 将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全,反应过程中容器内部分物质的质量变化如图所示,下列说法正确的是( )
将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全,反应过程中容器内部分物质的质量变化如图所示,下列说法正确的是( )- A. m=12.6
- B. 当CO2为8.8g时,CO的质量为11.2g
- C. 参加反应的铁的氧化物的质量为16g
- D. 铁的氧化物中x:y=2:3
题目解答
答案
B. 当CO2为8.8g时,CO的质量为11.2g
解析
本题主要考查质量守恒定律和元素守恒的应用,需结合化学反应中物质的质量变化进行分析。解题核心思路如下:
- 碳元素守恒:反应中CO转化为CO₂,碳元素的总量不变,据此可建立CO与CO₂的质量关系。
- 铁元素守恒:铁氧化物中的铁全部转化为单质铁,据此可计算铁氧化物中铁的质量。
- 质量守恒:反应前后总质量相等,结合已知数据推导铁氧化物的质量。
选项A分析
根据碳元素守恒,CO与CO₂的碳质量相等:
$\frac{28}{44} = \frac{m - 8.4}{13.2} \quad \Rightarrow \quad m = 16.8 \, \text{g}$
因此,选项A($m=12.6$)错误。
选项B分析
当CO₂质量为$8.8 \, \text{g}$时,设消耗的CO质量为$x$:
$\frac{28}{44} = \frac{x}{8.8} \quad \Rightarrow \quad x = 5.6 \, \text{g}$
剩余CO质量为:
$16.8 - 5.6 = 11.2 \, \text{g}$
选项B正确。
选项C分析
根据质量守恒,反应前总质量等于反应后总质量:
$16.8 + x = 8.4 + 13.2 + 8.4 \quad \Rightarrow \quad x = 21.6 \, \text{g}$
选项C($16 \, \text{g}$)错误。
选项D分析
铁氧化物中铁的质量为$16.8 \, \text{g}$,氧的质量为:
$21.6 - 16.8 = 4.8 \, \text{g}$
铁与氧的原子比为:
$\frac{16.8/56}{4.8/16} = 1:1 \quad \Rightarrow \quad x:y = 1:1$
选项D($2:3$)错误。