题目
298K时有一仅能透过水的渗透膜,将 .01molcdot (dm)^-3 和 .001molcdot (dm)^-3 的蔗糖溶液-|||-分开,欲使该体系达平衡需在 __ 溶液上方施加压力为 __ Pa。

题目解答
答案
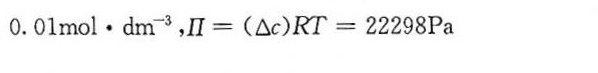
解析
步骤 1:确定渗透压公式
渗透压 $\Pi$ 可以通过公式 $\Pi = cRT$ 计算,其中 $c$ 是溶液的摩尔浓度,$R$ 是理想气体常数,$T$ 是绝对温度。在本题中,我们使用 $\Delta \Pi = (\Delta c)RT$ 来计算两个溶液之间的渗透压差,其中 $\Delta c$ 是两个溶液的摩尔浓度之差。
步骤 2:计算浓度差
两个溶液的摩尔浓度分别为 $0.01mol\cdot {dm}^{-3}$ 和 $0.001mol\cdot {dm}^{-3}$,因此浓度差 $\Delta c = 0.01mol\cdot {dm}^{-3} - 0.001mol\cdot {dm}^{-3} = 0.009mol\cdot {dm}^{-3}$。
步骤 3:计算渗透压差
将浓度差 $\Delta c$、理想气体常数 $R = 8.314 J\cdot mol^{-1}\cdot K^{-1}$ 和温度 $T = 298K$ 代入公式 $\Delta \Pi = (\Delta c)RT$,得到 $\Delta \Pi = 0.009mol\cdot {dm}^{-3} \times 8.314 J\cdot mol^{-1}\cdot K^{-1} \times 298K$。计算结果为 $\Delta \Pi = 22298Pa$。
步骤 4:确定施加压力的溶液
为了使体系达到平衡,需要在浓度较高的溶液上方施加压力,即在 $0.01mol\cdot {dm}^{-3}$ 的蔗糖溶液上方施加压力。
渗透压 $\Pi$ 可以通过公式 $\Pi = cRT$ 计算,其中 $c$ 是溶液的摩尔浓度,$R$ 是理想气体常数,$T$ 是绝对温度。在本题中,我们使用 $\Delta \Pi = (\Delta c)RT$ 来计算两个溶液之间的渗透压差,其中 $\Delta c$ 是两个溶液的摩尔浓度之差。
步骤 2:计算浓度差
两个溶液的摩尔浓度分别为 $0.01mol\cdot {dm}^{-3}$ 和 $0.001mol\cdot {dm}^{-3}$,因此浓度差 $\Delta c = 0.01mol\cdot {dm}^{-3} - 0.001mol\cdot {dm}^{-3} = 0.009mol\cdot {dm}^{-3}$。
步骤 3:计算渗透压差
将浓度差 $\Delta c$、理想气体常数 $R = 8.314 J\cdot mol^{-1}\cdot K^{-1}$ 和温度 $T = 298K$ 代入公式 $\Delta \Pi = (\Delta c)RT$,得到 $\Delta \Pi = 0.009mol\cdot {dm}^{-3} \times 8.314 J\cdot mol^{-1}\cdot K^{-1} \times 298K$。计算结果为 $\Delta \Pi = 22298Pa$。
步骤 4:确定施加压力的溶液
为了使体系达到平衡,需要在浓度较高的溶液上方施加压力,即在 $0.01mol\cdot {dm}^{-3}$ 的蔗糖溶液上方施加压力。