题目
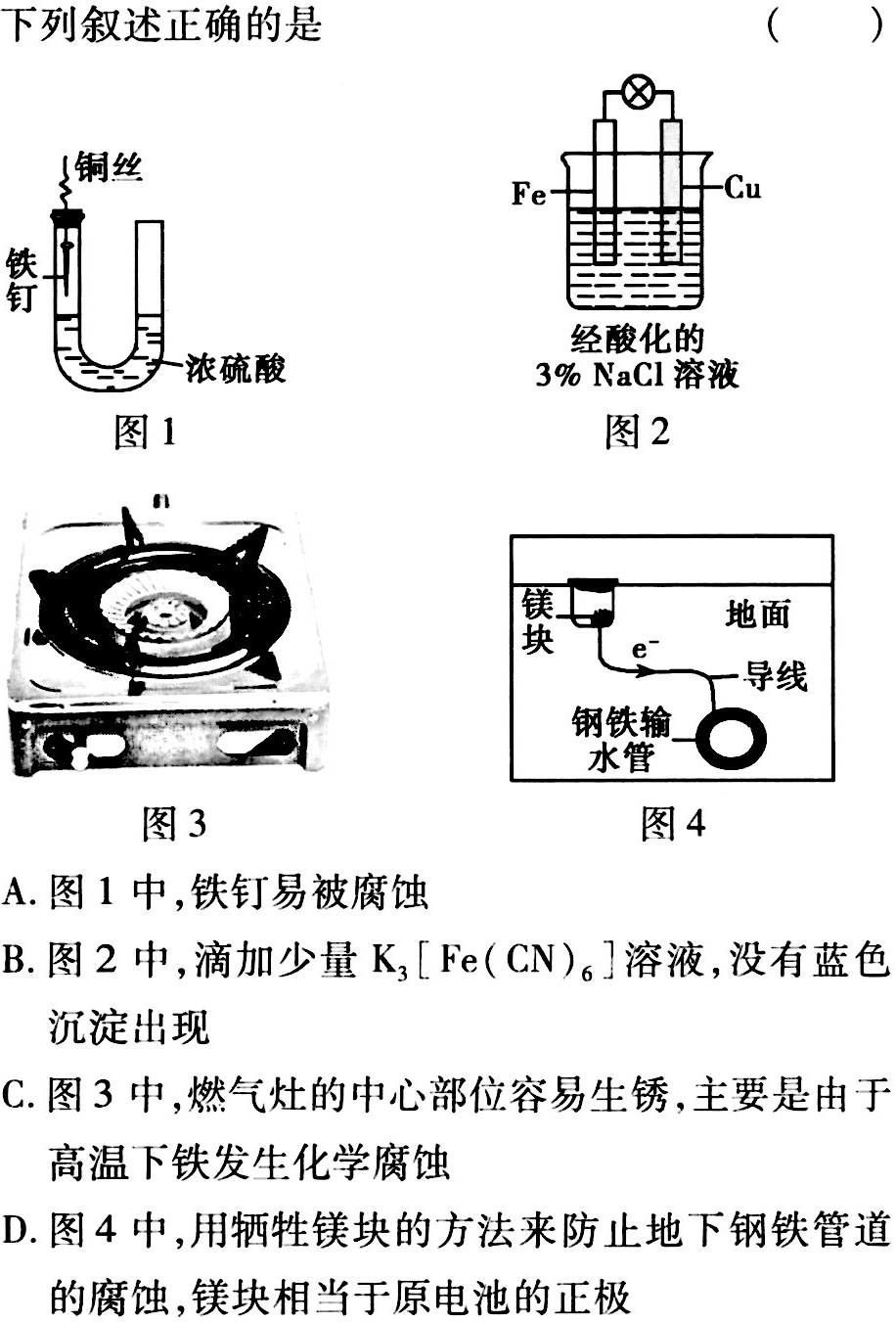
下列叙述正确的是 ()-|||-⑧-|||-铜丝 Cu-|||-Fe-|||-铁-|||-经酸化的-|||-一浓硫酸 3%NaCl溶液-|||-图1 图2-|||-块 e 导线-|||-地面-|||-i-|||-钢铁输 一-|||-水管-|||-图3 图4-|||-A.图1中,铁钉易被腐蚀-|||-B.图2中,滴加少量K3[Fe(CN)6 ]溶液,没有蓝色-|||-沉淀出现-|||-C.图3中,燃气灶的中心部位容易生锈,主要是由于-|||-高温下铁发生化学腐蚀-|||-D.图4中,用牺牲镁块的方法来防止地下钢铁管道-|||-的腐蚀,镁块相当于原电池的正极
题目解答
答案
解析
步骤 1:分析图1
图1中,铜丝和铁钉通过导线连接,形成原电池。铜丝作为正极,铁钉作为负极,铁钉易被腐蚀。
步骤 2:分析图2
图2中,铁钉浸入酸化的3%NaCl溶液中,铁钉发生腐蚀,生成Fe2+。滴加少量K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀。
步骤 3:分析图3
图3中,燃气灶的中心部位温度较高,铁发生化学腐蚀,容易生锈。
步骤 4:分析图4
图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块作为负极,钢铁管道作为正极,镁块相当于原电池的负极。
图1中,铜丝和铁钉通过导线连接,形成原电池。铜丝作为正极,铁钉作为负极,铁钉易被腐蚀。
步骤 2:分析图2
图2中,铁钉浸入酸化的3%NaCl溶液中,铁钉发生腐蚀,生成Fe2+。滴加少量K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀。
步骤 3:分析图3
图3中,燃气灶的中心部位温度较高,铁发生化学腐蚀,容易生锈。
步骤 4:分析图4
图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块作为负极,钢铁管道作为正极,镁块相当于原电池的负极。