题目
一. 1 mol理想气体由1013.25 kPa,5 dm3,609.4 K反抗恒外压101.325 kPa膨胀至40 dm3,压力等于外压,求此过程的W、Q、△U、△H、△S、△A、△G。已知CV,m=12.5 J·mol-1·K-1;始态熵值S1=200 J·K-1。
一. 1 mol理想气体由1013.25 kPa,5 dm3,609.4 K反抗恒外压101.325 kPa膨胀至40 dm3,压力等于外压,求此过程的W、Q、△U、△H、△S、△A、△G。已知CV,m=12.5 J·mol-1·K-1;始态熵值S1=200 J·K-1。
题目解答
答案
解: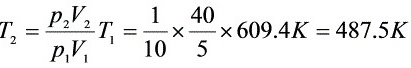
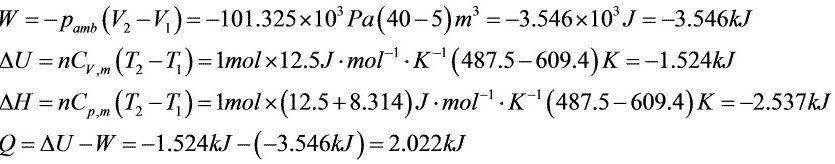
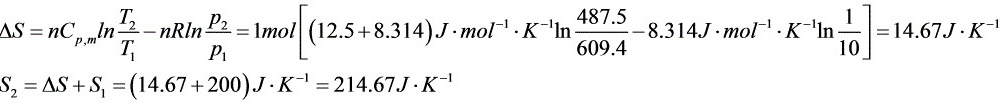
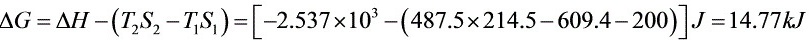
解析
步骤 1:计算终态温度
根据理想气体状态方程,可以计算终态温度。由于过程是反抗恒外压膨胀,终态压力等于外压,即101.325 kPa。利用理想气体状态方程PV=nRT,可以得到终态温度T2。
步骤 2:计算功W
对于反抗恒外压膨胀过程,功的计算公式为W=-P外(V2-V1)。其中,P外是恒定的外压,V2和V1分别是终态和始态的体积。
步骤 3:计算内能变化△U
内能变化△U可以通过计算热量Q和功W来得到。对于理想气体,内能变化只与温度变化有关,即△U=nCV,m(T2-T1)。
步骤 4:计算焓变△H
焓变△H可以通过内能变化△U和压力变化来计算。对于理想气体,焓变△H=nCP,m(T2-T1),其中CP,m=CV,m+R。
步骤 5:计算熵变△S
熵变△S可以通过计算热量Q和温度变化来得到。对于理想气体,熵变△S=nCV,m ln(T2/T1) + nR ln(V2/V1)。
步骤 6:计算吉布斯自由能变化△G和亥姆霍兹自由能变化△A
吉布斯自由能变化△G和亥姆霍兹自由能变化△A可以通过计算焓变△H、内能变化△U和熵变△S来得到。△G=△H-T△S,△A=△U-T△S。
根据理想气体状态方程,可以计算终态温度。由于过程是反抗恒外压膨胀,终态压力等于外压,即101.325 kPa。利用理想气体状态方程PV=nRT,可以得到终态温度T2。
步骤 2:计算功W
对于反抗恒外压膨胀过程,功的计算公式为W=-P外(V2-V1)。其中,P外是恒定的外压,V2和V1分别是终态和始态的体积。
步骤 3:计算内能变化△U
内能变化△U可以通过计算热量Q和功W来得到。对于理想气体,内能变化只与温度变化有关,即△U=nCV,m(T2-T1)。
步骤 4:计算焓变△H
焓变△H可以通过内能变化△U和压力变化来计算。对于理想气体,焓变△H=nCP,m(T2-T1),其中CP,m=CV,m+R。
步骤 5:计算熵变△S
熵变△S可以通过计算热量Q和温度变化来得到。对于理想气体,熵变△S=nCV,m ln(T2/T1) + nR ln(V2/V1)。
步骤 6:计算吉布斯自由能变化△G和亥姆霍兹自由能变化△A
吉布斯自由能变化△G和亥姆霍兹自由能变化△A可以通过计算焓变△H、内能变化△U和熵变△S来得到。△G=△H-T△S,△A=△U-T△S。