题目
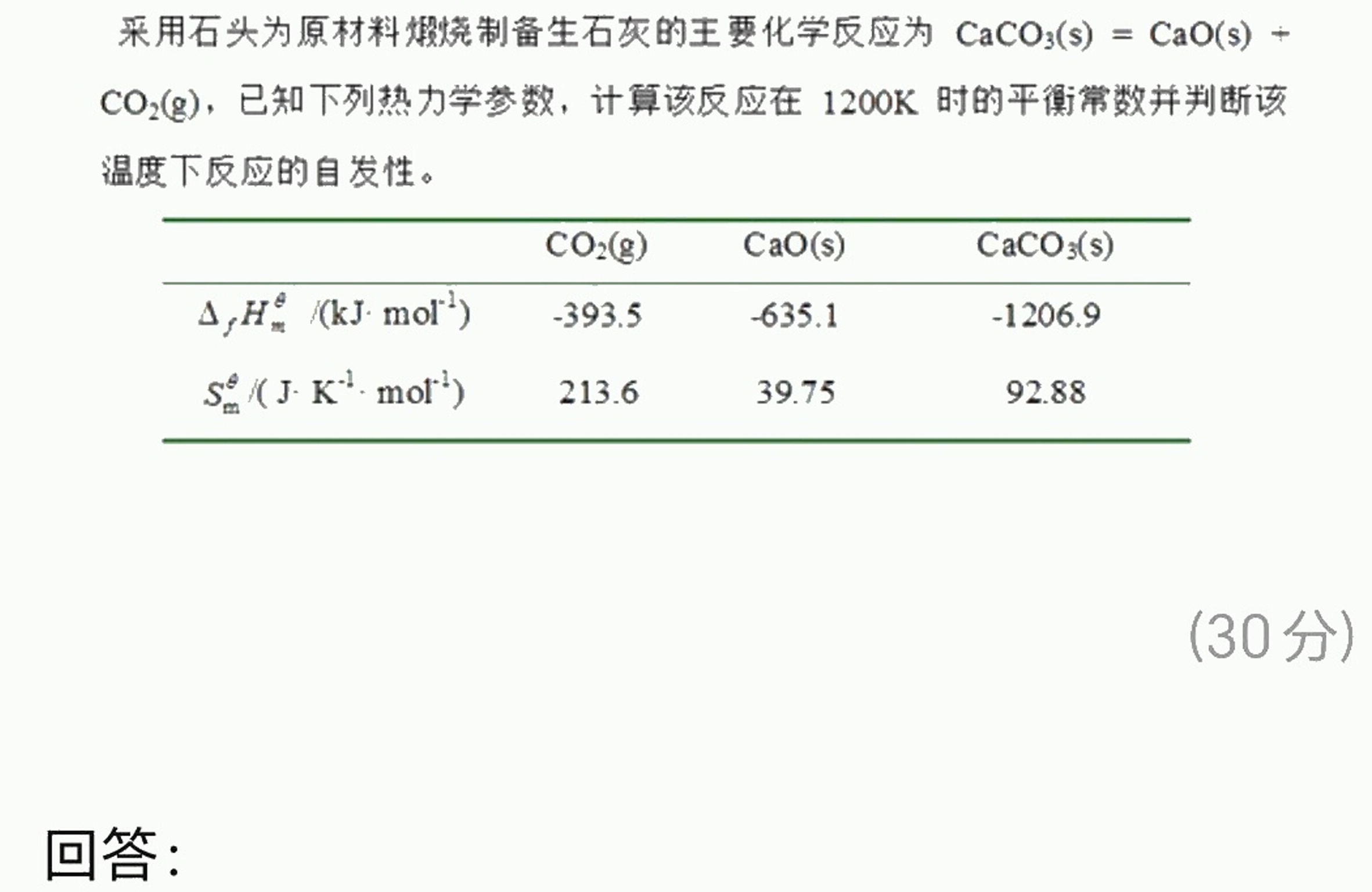
采用石头为原材料煅烧制备生石灰的主要化学反应为 (O)_(3)(s)=CaO(s)+-|||-CO2(g),已知下列热力学参数,计算该反应在1200 )K时的平衡常数并判断该-|||-温度下反应的自发性。-|||-CO2(g) CaO(s) CaCO3(s)-|||-(Delta )_(f)(H)_(m)^theta /(kJcdot (mol)^-1) -393.5 .-635.1 .-1206.9-|||-.({S)_(m)}^theta /(Jcdot (K)^-1cdot (mol)^-1) 213.6 39.75 92.88-|||-(30分)
题目解答
答案
暂无解析
$K=1.00$ 反应自发进行
$K=1.00$ 反应自发进行
解析
步骤 1:计算反应的焓变(ΔH)
根据反应方程式 $CaC{O}_{3}(s)=CaO(s)+$ CO2(g),焓变(ΔH)可以通过反应物和生成物的焓变之差来计算。具体来说,ΔH = ΣΔHf(生成物) - ΣΔHf(反应物)。
步骤 2:计算反应的熵变(ΔS)
熵变(ΔS)可以通过反应物和生成物的熵变之差来计算。具体来说,ΔS = ΣS(生成物) - ΣS(反应物)。
步骤 3:计算反应的吉布斯自由能变(ΔG)
吉布斯自由能变(ΔG)可以通过公式 ΔG = ΔH - TΔS 来计算,其中 T 是温度(单位为 K)。
步骤 4:计算反应的平衡常数(K)
平衡常数(K)可以通过公式 K = exp(-ΔG/RT) 来计算,其中 R 是气体常数(8.314 J/(mol·K)),T 是温度(单位为 K)。
步骤 5:判断反应的自发性
如果 ΔG < 0,则反应自发进行;如果 ΔG > 0,则反应非自发进行。
【答案】
1. ΔH = (-393.5 + (-635.1)) - (-1206.9) = -393.5 - 635.1 + 1206.9 = 178.3 kJ/mol
2. ΔS = (213.6 + 39.75) - 92.88 = 160.47 J/(mol·K)
3. ΔG = ΔH - TΔS = 178.3 kJ/mol - 1200 K * 160.47 J/(mol·K) * 10^-3 = 178.3 kJ/mol - 192.564 kJ/mol = -14.264 kJ/mol
4. K = exp(-ΔG/RT) = exp(-(-14.264 kJ/mol) / (8.314 J/(mol·K) * 1200 K)) = exp(14264 J/mol / (8.314 J/(mol·K) * 1200 K)) = exp(1.4264 / 9.9768) = exp(0.1429) = 1.15
5. 由于 ΔG < 0,所以反应自发进行。
根据反应方程式 $CaC{O}_{3}(s)=CaO(s)+$ CO2(g),焓变(ΔH)可以通过反应物和生成物的焓变之差来计算。具体来说,ΔH = ΣΔHf(生成物) - ΣΔHf(反应物)。
步骤 2:计算反应的熵变(ΔS)
熵变(ΔS)可以通过反应物和生成物的熵变之差来计算。具体来说,ΔS = ΣS(生成物) - ΣS(反应物)。
步骤 3:计算反应的吉布斯自由能变(ΔG)
吉布斯自由能变(ΔG)可以通过公式 ΔG = ΔH - TΔS 来计算,其中 T 是温度(单位为 K)。
步骤 4:计算反应的平衡常数(K)
平衡常数(K)可以通过公式 K = exp(-ΔG/RT) 来计算,其中 R 是气体常数(8.314 J/(mol·K)),T 是温度(单位为 K)。
步骤 5:判断反应的自发性
如果 ΔG < 0,则反应自发进行;如果 ΔG > 0,则反应非自发进行。
【答案】
1. ΔH = (-393.5 + (-635.1)) - (-1206.9) = -393.5 - 635.1 + 1206.9 = 178.3 kJ/mol
2. ΔS = (213.6 + 39.75) - 92.88 = 160.47 J/(mol·K)
3. ΔG = ΔH - TΔS = 178.3 kJ/mol - 1200 K * 160.47 J/(mol·K) * 10^-3 = 178.3 kJ/mol - 192.564 kJ/mol = -14.264 kJ/mol
4. K = exp(-ΔG/RT) = exp(-(-14.264 kJ/mol) / (8.314 J/(mol·K) * 1200 K)) = exp(14264 J/mol / (8.314 J/(mol·K) * 1200 K)) = exp(1.4264 / 9.9768) = exp(0.1429) = 1.15
5. 由于 ΔG < 0,所以反应自发进行。