4.实验测得某氨水的pH为11.26,已知 _(b)(N(H)_(3))=1.79times (10)^-5, 求氨水的浓度。
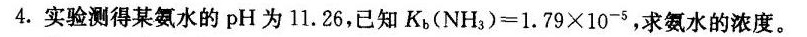
题目解答
答案
解析
考查要点:本题主要考查弱碱溶液中浓度的计算,涉及pH与氢氧根离子浓度的转换,以及利用解离常数公式建立方程求解浓度。
解题核心思路:
- 由pH求氢氧根浓度:通过pH计算pOH,再利用公式$[OH^-] = 10^{-pOH}$得到氢氧根浓度。
- 建立解离平衡关系:根据氨水的解离平衡式,利用$K_b = \frac{[NH_4^+][OH^-]}{[NH_3]}$,结合弱碱解离度小的近似条件(假设$[NH_3] \approx c$),简化公式求解浓度。
破题关键点:
- 正确转换pH与氢氧根浓度,注意计算精度。
- 合理应用近似条件,简化方程求解。
步骤1:计算氢氧根浓度
已知溶液的$pH = 11.26$,根据$pH + pOH = 14$,得:
$pOH = 14 - 11.26 = 2.74$
氢氧根浓度为:
$[OH^-] = 10^{-pOH} = 10^{-2.74} \approx 1.817 \times 10^{-3} \, \text{mol/L}$
步骤2:建立解离平衡关系
氨水的解离平衡式为:
$NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^-$
设氨水的初始浓度为$c$,解离出的$[OH^-] = x \approx 1.817 \times 10^{-3}$。
根据$K_b$的表达式:
$K_b = \frac{x^2}{c - x}$
由于氨水是弱碱,解离度小,可近似$[NH_3] \approx c$,即:
$K_b \approx \frac{x^2}{c}$
步骤3:代入已知数据求解
将$K_b = 1.79 \times 10^{-5}$和$x = 1.817 \times 10^{-3}$代入公式:
$c = \frac{x^2}{K_b} = \frac{(1.817 \times 10^{-3})^2}{1.79 \times 10^{-5}} \approx \frac{3.301 \times 10^{-6}}{1.79 \times 10^{-5}} \approx 0.184 \, \text{mol/L}$
四舍五入后得:
$c \approx 0.185 \, \text{mol/L}$