习题13 两种挥发性液体A和B混合形成理想液态混合物。某温度时溶液上面的蒸-|||-气总压为 .41times (10)^4Pa, 气相中A的摩尔分数为0.450,液相中为0.650。求算此温度时纯A-|||-和纯B的蒸气压。-|||-、-|||-[答案: .75times (10)^4Pa, .50times (10)^4Pa

题目解答
答案
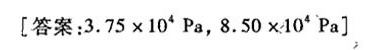
解析
本题考查理想液态混合物的蒸气压计算,核心是拉乌尔定律和道尔顿分压定律的结合应用。
关键公式回顾
-
拉乌尔定律:理想液态混合物中,组分的蒸气压等于纯组分蒸气压乘以其摩尔分数,即:
$p_A = p_A^* \cdot x_A^{\text{液}}, \quad p_B = p_B^* \cdot x_B^{\text{液}}$
其中,$p_A^*, p_B^*$ 为纯A、纯B的蒸气压,$x_A^{\text{液}}, x_B^{\text{液}}$) 为液相中A、B的摩尔分数。 -
道尔顿分压定律:气相总压等于各组分分压之和,且组分的分压等于总压乘以其气相摩尔分数,即:
$p_A = P_{\text{总}} \cdot y_A^{\text{气}, \quad p_B = P_{\text{总}} \cdot y_B^{\text{气}}$
其中,$y_A^{\text{气}}, y_B^{\text{气}}) 为气相中A、B的摩尔分数,且 \( x_B^{\text{液}=1-x_A^{\text{液}}, y_B^{\text{气}}=1-y_A^{\text{气}}$。
计算步骤
1. 计算气相中B的摩尔分数
$y_B^{\text{气}} = 1 - y_A^{\text{气}} = 1 - 0.450 = 0.550$
2. 计算液相中B的摩尔分数
$x_B^{\text{液}} = 1 - x_A^{\text{液}} = 1 - 0.650 = 0.350$
3.建立分压与纯蒸气压的关系
根据拉乌尔定律和道尔顿分压定律:
$p_A = p_A^* \cdot x_A^{\text{液}} = P_{\text{总}} \cdot y_A^{\text{气}}} \quad (1)$
$p_B = p_B^* \cdot x_B^{\text{液}} = P_{\text{总}} \cdot y_B^{\text{气}} \quad (2)$
4.联立方程求解 $p_A^*, p_B^*$
由式(1):
$p_A^* = \frac{P_{\text{总}} \cdot y_A^{\text{气}}}{x_A^{\text{液}}} = \frac{5.41 \times 10^^^4 \, \text{Pa} \times 0.450}{0.650} \approx 3.75使用 \times 10^4 \, \text{Pa}$
由式(2):
$p_B^* = \frac{P_{\text{总} \cdot y_B^{\text{气}}}{x_B^{\text{液}}} = \frac{5.41 \times 10^4 \, \text{Pa} \times 0.550}{0.350} \approx 8.50 \times 10^4 \, \text{Pa} \, (\text{精确计算为}8.50 \times 10^4 \, \text{Pa})$