题目
设反应+bBarrow C,在恒温下,当+bBarrow C恒定时,若将+bBarrow C增大为原来的2倍,测得其反应速率亦增大为原来的2倍;当+bBarrow C恒定时,若将+bBarrow C增大为原来的2倍,测得其反应速率增大为原来的4倍。试写出此反应的速率方程式,它是几级反应?
设反应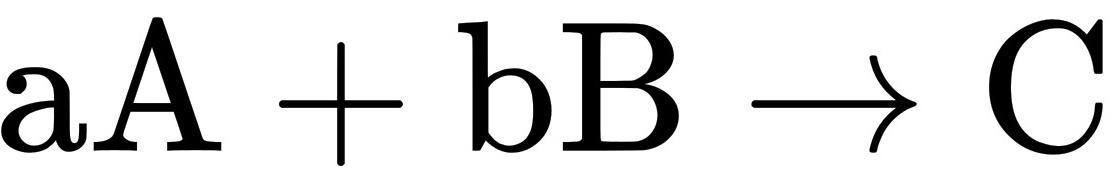 ,在恒温下,当
,在恒温下,当 恒定时,若将
恒定时,若将 增大为原来的2倍,测得其反应速率亦增大为原来的2倍;当
增大为原来的2倍,测得其反应速率亦增大为原来的2倍;当 恒定时,若将
恒定时,若将 增大为原来的2倍,测得其反应速率增大为原来的4倍。试写出此反应的速率方程式,它是几级反应?
增大为原来的2倍,测得其反应速率增大为原来的4倍。试写出此反应的速率方程式,它是几级反应?
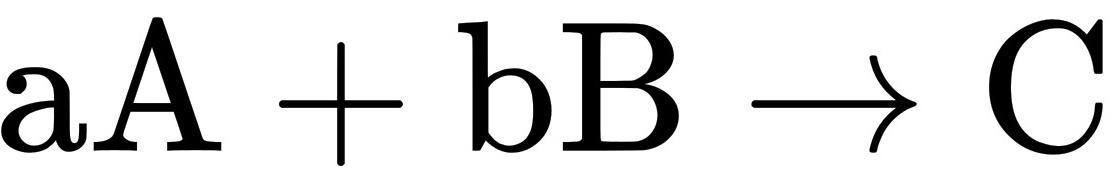 ,在恒温下,当
,在恒温下,当 恒定时,若将
恒定时,若将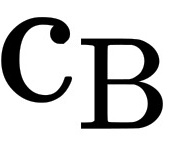 增大为原来的2倍,测得其反应速率亦增大为原来的2倍;当
增大为原来的2倍,测得其反应速率亦增大为原来的2倍;当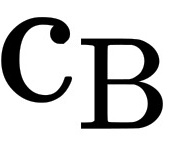 恒定时,若将
恒定时,若将 增大为原来的2倍,测得其反应速率增大为原来的4倍。试写出此反应的速率方程式,它是几级反应?
增大为原来的2倍,测得其反应速率增大为原来的4倍。试写出此反应的速率方程式,它是几级反应?题目解答
答案

解析
考查要点:本题主要考查化学反应速率方程式的确定方法,以及反应级数的计算。
解题思路:
- 速率方程形式:假设速率方程为 $v = k[A]^\alpha [B]^\beta$,其中 $\alpha$ 和 $\beta$ 分别为A、B的级数。
- 条件分析:通过题目中给出的浓度变化与速率变化的关系,建立方程求解 $\alpha$ 和 $\beta$。
- 总级数计算:将 $\alpha$ 和 $\beta$ 相加得到反应的总级数。
破题关键:
- 分情况讨论:分别利用两种不同条件下的浓度变化与速率变化的关系,分别求出 $\alpha$ 和 $\beta$。
- 指数关系:速率变化的倍数与浓度变化的倍数的指数关系是核心,需正确建立比例式。
设速率方程为 $v = k[A]^\alpha [B]^\beta$。
当 $[A]$ 恒定时
此时速率与 $[B]^\beta$ 成正比。
根据题意,$[B]$ 增大为原来的2倍,速率也增大为原来的2倍:
$\frac{v_2}{v_1} = \frac{(2[B])^\beta}{[B]^\beta} = 2^\beta = 2 \implies \beta = 1.$
当 $[B]$ 恒定时
此时速率与 $[A]^\alpha$ 成正比。
根据题意,$[A]$ 增大为原来的2倍,速率增大为原来的4倍:
$\frac{v_2}{v_1} = \frac{(2[A])^\alpha}{[A]^\alpha} = 2^\alpha = 4 \implies \alpha = 2.$
速率方程与总级数
将 $\alpha = 2$ 和 $\beta = 1$ 代入速率方程:
$v = k[A]^2 [B].$
总级数为 $\alpha + \beta = 2 + 1 = 3$,因此是三级反应。