题目
10.333K时,纯液体A和纯液体B的蒸气压分别等于40.00kPa和80.00kPa。在该温度-|||-时,A和B能完全反应并形成一非常稳定的化合物AB,AB的蒸气压为13.33kPa。已知B-|||-和AB组成的溶液为理想液态混合物。求333K时,一个含有1mol A和4molB的溶液的蒸-|||-气压和蒸气组成。-|||-a n-n

题目解答
答案
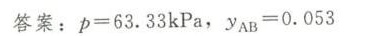
解析
本题考查理想液态混合物的蒸气压计算以及拉乌尔定律的应用。解题的关键思路是先根据化学反应确定溶液中各物质的实际组成,再利用理想液态混合物的性质和拉乌尔定律分别计算各物质的分压,进而得到溶液的总蒸气压和蒸气组成。
- 确定溶液中各物质的实际组成:
- 已知$A$和$B$能完全反应生成$AB$,反应方程式为$A + B \longrightarrow AB$。
- 溶液中有$1molA$和$4molB$,根据反应的化学计量关系,$1molA$与$1molB$反应生成$1molAB$,反应后剩余$B$的物质的量为$4mol - 1mol = 3mol$。
- 此时溶液由$1molAB$和$3molB$组成。
- 计算$AB$和$B$的摩尔分数:
- 溶液中物质的总物质的量$n_{总}=n_{AB}+n_{B}=1mol + 3mol = 4mol$。
- 根据摩尔分数的定义$x_i=\frac{n_i}{n_{总}}$,可得$AB$的摩尔分数$x_{AB}=\frac{n_{AB}}{n_{总}}=\frac{1mol}{4mol}=0.25$,$B$的摩尔分数$x_{B}=\frac{n_{B}}{n_{总}}=\frac{3mol}{4mol}=0.75$。
- 计算$AB$和$B$的分压:
- 因为$B$和$AB$组成的溶液为理想液态混合物,根据拉乌尔定律$p_i = p_i^*\cdot x_i$(其中$p_i$为组分$i$的分压,$p_i^*$为纯组分$i$的蒸气压,$x_i$为组分$i$的摩尔分数)。
- 已知$p_{AB}^* = 13.33kPa$,$p_{B}^* = 80.00kPa$,则$AB$的分压$p_{AB}=p_{AB}^*\cdot x_{AB}=13.33kPa\times0.25 = 3.3325kPa$。
- $B$的分压$p_{B}=p_{B}^*\cdot x_{B}=80.00kPa\times0.75 = 60kPa$。
- 计算溶液的总蒸气压:
- 根据道尔顿分压定律$p_{总}=p_{AB}+p_{B}$,将$p_{AB}=3.3325kPa$,$p_{B}=60kPa$代入可得$p_{总}=3.3325kPa + 60kPa = 63.3325kPa\approx63.33kPa$。
- 计算蒸气中$AB$的摩尔分数$y_{AB}$:
- 根据分压与摩尔分数的关系$y_i=\frac{p_i}{p_{总}}$,可得$y_{AB}=\frac{p_{AB}}{p_{总}}=\frac{3.3325kPa}{63.3325kPa}\approx0.053$。