7.17 在 (Mg(Cl)_(2))=0.010molcdot (L)^-1 和 (N(H)_(3)cdot (H)_(2)O)=0.10molcdot (L)^-1 的混合溶液-|||-中, (N{H)_(4)}^+ 的浓度至少为多大时才能防止生成Mg(OH)2沉淀?
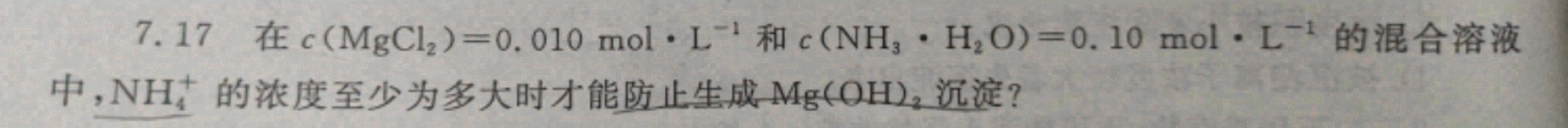
题目解答
答案

解析
本题考察难溶电解质的沉淀溶解平衡和弱电解质的解离平衡的综合应用,核心思路是通过控制$OH^-$浓度防止$Mg(OH)_2$沉淀生成,再利用氨水溶液的解离平衡计算所需$(NH_4^+$浓度。
步骤1:确定不生成$Mg(OH)_2$沉淀的$OH^-$浓度上限
$Mg(OH)_2$的沉淀溶解平衡为:
$Mg(OH)_2(s) \rightleftharpoons Mg^{2+(aq) + 2OH^-(aq)$
溶度积常数表达式:
$K_{sp}(Mg(OH)_2) = [Mg^{2+}][OH^-]^2$
为防止沉淀生成,需满足$Q < K_{sp}$,即:
$[OH^-]^2 < \frac{K_{sp}(Mg(OH)_2)}{[Mg^{2+}]}$
}]
代入数据:
$[Mg^{2+}] = 0.010\ mol/L$
$K_{sp}(Mg(OH)_2) = 5.6 \times 10^{-12}$
计算得:
$[OH^-]^2 < \frac{5.6 \times 10^{-12}}{0.010} = 5.6 \times 10^{-10}$
$[OH^-] < \sqrt{5.6 \times 10^{-10}} \approx 7.48 \times 10^{-5}\ mol/L$
**步骤2:利用氨水溶液的解离平衡计算\(NH₄⁺)浓度** 氨水溶液的解离平衡为: $NH_3 \cdot H_2O \rightleftharpoons NH_4^+ + OH^-$ 解离常数表达式: $K_b = \frac{[NH_4^+][OH^-]}{[NH_3 \cdot H_2O]}$ 为维持$OH^-$浓度不超过过步骤1,需$NH_4^+$浓度满足:
$[NH_4^+] = \frac{K_b [NH_3 \cdot H_2O]}{[OH^-]}$
代入数据:
$K_b = 1.77 \times 10^{-5}$
$[NH_3 \cdot H_2O] = 0.10\ mol/L$
$[OH^-] \approx 7.48 \times 10^{-5}\ mol/L$
计算得:
$[NH_4^+] \approx \frac{1.77 \times 10^{-5} \times 0.10}{7.48 \times 10^{-5}} \approx 0.075\ mol/L$