题目
20.用 .1000molcdot (L)^-1NaOH 溶液滴定 .1000molcdot (L)^-1(H)_(3)P(O)_(4) 溶液至第一化学计量-|||-点,若终点pH较化学计量点pH高0.5单位,计算终点误差。

题目解答
答案
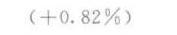
解析
步骤 1:确定第一化学计量点的pH值
在第一化学计量点,$H_3PO_4$ 被完全中和为 $H_2PO_4^-$。根据磷酸的酸性,$H_2PO_4^-$ 的pH值主要由其二级酸性决定。磷酸的二级酸性常数 $K_{a2} = 6.2 \times 10^{-8}$,因此,$H_2PO_4^-$ 的pH值可以通过以下公式计算:
$$
pH = pK_{a2} + \log\left(\frac{[HPO_4^{2-}]}{[H_2PO_4^-]}\right)
$$
由于在第一化学计量点,$[HPO_4^{2-}] = [H_2PO_4^-]$,因此:
$$
pH = pK_{a2} = -\log(6.2 \times 10^{-8}) = 7.21
$$
步骤 2:计算终点pH值
根据题目,终点pH值比化学计量点pH值高0.5单位,因此:
$$
pH_{终点} = 7.21 + 0.5 = 7.71
$$
步骤 3:计算终点误差
终点误差可以通过以下公式计算:
$$
\text{终点误差} = \frac{V_{终点} - V_{化学计量点}}{V_{化学计量点}} \times 100\%
$$
其中,$V_{化学计量点}$ 是滴定至第一化学计量点时消耗的NaOH溶液体积,$V_{终点}$ 是滴定至终点时消耗的NaOH溶液体积。由于滴定过程中,pH值的变化与NaOH溶液体积的变化成正比,因此:
$$
\frac{V_{终点} - V_{化学计量点}}{V_{化学计量点}} = \frac{pH_{终点} - pH_{化学计量点}}{pH_{化学计量点}}
$$
代入数值:
$$
\frac{V_{终点} - V_{化学计量点}}{V_{化学计量点}} = \frac{7.71 - 7.21}{7.21} = 0.07
$$
因此,终点误差为:
$$
\text{终点误差} = 0.07 \times 100\% = 7\%
$$
在第一化学计量点,$H_3PO_4$ 被完全中和为 $H_2PO_4^-$。根据磷酸的酸性,$H_2PO_4^-$ 的pH值主要由其二级酸性决定。磷酸的二级酸性常数 $K_{a2} = 6.2 \times 10^{-8}$,因此,$H_2PO_4^-$ 的pH值可以通过以下公式计算:
$$
pH = pK_{a2} + \log\left(\frac{[HPO_4^{2-}]}{[H_2PO_4^-]}\right)
$$
由于在第一化学计量点,$[HPO_4^{2-}] = [H_2PO_4^-]$,因此:
$$
pH = pK_{a2} = -\log(6.2 \times 10^{-8}) = 7.21
$$
步骤 2:计算终点pH值
根据题目,终点pH值比化学计量点pH值高0.5单位,因此:
$$
pH_{终点} = 7.21 + 0.5 = 7.71
$$
步骤 3:计算终点误差
终点误差可以通过以下公式计算:
$$
\text{终点误差} = \frac{V_{终点} - V_{化学计量点}}{V_{化学计量点}} \times 100\%
$$
其中,$V_{化学计量点}$ 是滴定至第一化学计量点时消耗的NaOH溶液体积,$V_{终点}$ 是滴定至终点时消耗的NaOH溶液体积。由于滴定过程中,pH值的变化与NaOH溶液体积的变化成正比,因此:
$$
\frac{V_{终点} - V_{化学计量点}}{V_{化学计量点}} = \frac{pH_{终点} - pH_{化学计量点}}{pH_{化学计量点}}
$$
代入数值:
$$
\frac{V_{终点} - V_{化学计量点}}{V_{化学计量点}} = \frac{7.71 - 7.21}{7.21} = 0.07
$$
因此,终点误差为:
$$
\text{终点误差} = 0.07 \times 100\% = 7\%
$$