题目
如图是部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数递增的变化情况,a→h代表八种元素,请根据推断出的元素回答下列问题:+1-|||-+3-|||-+4+5-2 le-|||--2 -1-|||-径 +1-|||-原子序数(1)c的元素符号 ____ ,它在元素周期表中位于第 ____ 周期,第 ____ 族。(2)由a和b组成含10个电子的分子的电子式 ____ 。(3)d和e形成的既含离子键又含非极性共价键的化合物的化学式为 ____ ,该化合物中阴离子与阳离子的个数比为 ____ ,该物质与水反应的化学方程式为 ____ 。(4)e的最高价氧化物的水化物与f的最高价氧化物的水化物反应的离子方程式为 ____ 。(5)能比较元素g、h的非金属性强弱的实验事实是 ____ (填标号)。A.h单质可从g的氢化物的水溶液中置换出g单质B.g的氢化物水溶液的酸性比h的氢化物水溶液的酸性弱C.h的氢化物的稳定性比g的氢化物的稳定性强
如图是部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数递增的变化情况,a→h代表八种元素,请根据推断出的元素回答下列问题:
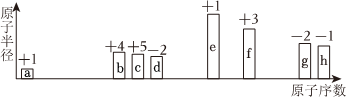
(1)c的元素符号 ____ ,它在元素周期表中位于第 ____ 周期,第 ____ 族。
(2)由a和b组成含10个电子的分子的电子式 ____ 。
(3)d和e形成的既含离子键又含非极性共价键的化合物的化学式为 ____ ,该化合物中阴离子与阳离子的个数比为 ____ ,该物质与水反应的化学方程式为 ____ 。
(4)e的最高价氧化物的水化物与f的最高价氧化物的水化物反应的离子方程式为 ____ 。
(5)能比较元素g、h的非金属性强弱的实验事实是 ____ (填标号)。
A.h单质可从g的氢化物的水溶液中置换出g单质
B.g的氢化物水溶液的酸性比h的氢化物水溶液的酸性弱
C.h的氢化物的稳定性比g的氢化物的稳定性强

(1)c的元素符号 ____ ,它在元素周期表中位于第 ____ 周期,第 ____ 族。
(2)由a和b组成含10个电子的分子的电子式 ____ 。
(3)d和e形成的既含离子键又含非极性共价键的化合物的化学式为 ____ ,该化合物中阴离子与阳离子的个数比为 ____ ,该物质与水反应的化学方程式为 ____ 。
(4)e的最高价氧化物的水化物与f的最高价氧化物的水化物反应的离子方程式为 ____ 。
(5)能比较元素g、h的非金属性强弱的实验事实是 ____ (填标号)。
A.h单质可从g的氢化物的水溶液中置换出g单质
B.g的氢化物水溶液的酸性比h的氢化物水溶液的酸性弱
C.h的氢化物的稳定性比g的氢化物的稳定性强
题目解答
答案
解:从图中的化合价、原子半径、原子序数的大小,可知a是H元素,b是C元素,c是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;
(1)c的元素符号是N,它在元素周期表中位于第二周期第ⅤA族,
故答案为:N;二;VA;
(2)由a和b组成含10个电子的分子为CH4,其电子式为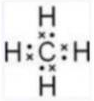 ,
,
故答案为: ;
;
(3)d和e形成的既含离子键又含非极性共价键的化合物的化学式为Na2O2,由钠离子与过氧根离子构成,该化合物中阴离子与阳离子的个数比为1:2,该物质与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:Na2O2;1:2;2Na2O2+2H2O=4NaOH+O2↑;
(4)e的最高价氧化物的水化物是NaOH,f的最高价氧化物的水化物是Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(5)A.h单质可从g的氢化物的水溶液中置换出g单质,说明h单质氧化性强,则h的非金属性比g强,故A正确;
B.氢化物水溶液酸性强弱不能比较中心元素的非金属性强弱,如非金属性:F>O>Cl,HF是弱酸,H2O呈中性,而HCl是强酸,故B错误;
C.氢化物稳定性与中心元素非金属性强弱一致,h的氢化物的稳定性比g的氢化物的稳定性强,说明h反非金属性比g强,故C正确,
故答案为:AC。
(1)c的元素符号是N,它在元素周期表中位于第二周期第ⅤA族,
故答案为:N;二;VA;
(2)由a和b组成含10个电子的分子为CH4,其电子式为
 ,
,故答案为:
 ;
;(3)d和e形成的既含离子键又含非极性共价键的化合物的化学式为Na2O2,由钠离子与过氧根离子构成,该化合物中阴离子与阳离子的个数比为1:2,该物质与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:Na2O2;1:2;2Na2O2+2H2O=4NaOH+O2↑;
(4)e的最高价氧化物的水化物是NaOH,f的最高价氧化物的水化物是Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(5)A.h单质可从g的氢化物的水溶液中置换出g单质,说明h单质氧化性强,则h的非金属性比g强,故A正确;
B.氢化物水溶液酸性强弱不能比较中心元素的非金属性强弱,如非金属性:F>O>Cl,HF是弱酸,H2O呈中性,而HCl是强酸,故B错误;
C.氢化物稳定性与中心元素非金属性强弱一致,h的氢化物的稳定性比g的氢化物的稳定性强,说明h反非金属性比g强,故C正确,
故答案为:AC。
解析
本题考查短周期元素的推断及元素化合物性质的应用。解题核心在于根据化合价、原子半径变化趋势及原子序数关系确定各元素。关键点包括:
- 原子半径变化:同周期时,原子半径随原子序数增大而减小;同主族时,原子半径随原子序数增大而增大。
- 化合价与元素位置:最高正价通常等于主族序数,非金属的最低负价等于主族序数减8。
- 特殊结构判断:如含离子键与非极性键的化合物(如Na₂O₂),需结合元素的金属性与非金属性强弱。
元素推断
- a→h的原子序数递增,结合化合价变化:
- a(+1价)为H,b(+4价)为C,c(+5价)为N,d(-2价)为O。
- e(+1价)为Na,f(+3价)为Al,g(-2价)为S,h(-1价)为Cl。
第(1)题
c的元素符号及位置
- c对应N元素,位于第二周期ⅤA族。
第(2)题
含10电子的分子电子式
- a(H)与b(C)组成CH₄,电子式为:
$\text{:C(H)_4:}$
第(3)题
Na₂O₂的性质与反应
- 化学式:Na₂O₂含离子键(Na⁺与O₂²⁻间)和非极性共价键(O-O单键)。
- 阴、阳离子个数比:1:2(1个O₂²⁻对应2个Na⁺)。
- 与水反应:
$2\text{Na}_2\text{O}_2 + 2\text{H}_2\text{O} \rightarrow 4\text{NaOH} + \text{O}_2↑$
第(4)题
NaOH与Al(OH)₃的反应
- 离子方程式为:
$\text{Al(OH)}_3 + \text{OH}^- \rightarrow \text{[Al(OH)}_4\text{]}^-$
第(5)题
非金属性比较
- A、C正确:Cl₂置换S(氧化性强),HCl稳定性强于H₂S(说明Cl非金属性更强)。