题目
要配制10mL pH=5的HAc-NaAc缓冲液,问需浓度为1.0 mol•L-1的HAc和NaAc溶液各多少毫升?
要配制10mL pH=5的HAc-NaAc缓冲液,问需浓度为1.0 mol•L-1的HAc和NaAc溶液各多少毫升?
题目解答
答案
解: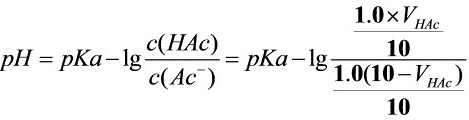
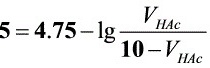
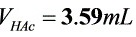
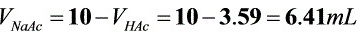
解析
步骤 1:确定缓冲溶液的pH值和pKa值
题目中给出的缓冲溶液的pH值为5,而HAc(乙酸)的pKa值为4.75。pKa值是酸的解离常数的负对数,表示酸的强度。pH值是溶液中氢离子浓度的负对数,表示溶液的酸碱性。
步骤 2:应用缓冲溶液的pH计算公式
缓冲溶液的pH值可以通过Henderson-Hasselbalch方程来计算,该方程为:$pH = pKa - \lg \dfrac{[A^-]}{[HA]}$,其中$[A^-]$是缓冲溶液中弱酸盐的浓度,$[HA]$是弱酸的浓度。将题目中的pH值和pKa值代入方程,得到:$5 = 4.75 - \lg \dfrac{[NaAc]}{[HAc]}$。
步骤 3:计算HAc和NaAc的体积
题目中给出的缓冲溶液的总体积为10mL,且HAc和NaAc的浓度均为1.0 mol•L-1。设HAc的体积为$V_{HAc}$,NaAc的体积为$V_{NaAc}$,则有$V_{HAc} + V_{NaAc} = 10$。将$[NaAc]$和$[HAc]$的浓度代入步骤2中的方程,得到:$5 = 4.75 - \lg \dfrac{1.0 \times V_{NaAc}}{1.0 \times V_{HAc}}$。解这个方程,可以得到$V_{HAc}$和$V_{NaAc}$的值。
题目中给出的缓冲溶液的pH值为5,而HAc(乙酸)的pKa值为4.75。pKa值是酸的解离常数的负对数,表示酸的强度。pH值是溶液中氢离子浓度的负对数,表示溶液的酸碱性。
步骤 2:应用缓冲溶液的pH计算公式
缓冲溶液的pH值可以通过Henderson-Hasselbalch方程来计算,该方程为:$pH = pKa - \lg \dfrac{[A^-]}{[HA]}$,其中$[A^-]$是缓冲溶液中弱酸盐的浓度,$[HA]$是弱酸的浓度。将题目中的pH值和pKa值代入方程,得到:$5 = 4.75 - \lg \dfrac{[NaAc]}{[HAc]}$。
步骤 3:计算HAc和NaAc的体积
题目中给出的缓冲溶液的总体积为10mL,且HAc和NaAc的浓度均为1.0 mol•L-1。设HAc的体积为$V_{HAc}$,NaAc的体积为$V_{NaAc}$,则有$V_{HAc} + V_{NaAc} = 10$。将$[NaAc]$和$[HAc]$的浓度代入步骤2中的方程,得到:$5 = 4.75 - \lg \dfrac{1.0 \times V_{NaAc}}{1.0 \times V_{HAc}}$。解这个方程,可以得到$V_{HAc}$和$V_{NaAc}$的值。