题目
对于反应 (H)_(4)(g)+2(O)_(2)(g)=!=!= C(O)_(2)(g)+2(H)_(2)O(g)-|||-(1)在恒压下,升高反应体系的温度,此反应的标准平衡常数K^2/ () ,CO2的摩尔分数-|||-x(CO2) () 。-|||-(2)在恒温下,增加反应体系的平衡压力,而使体系的体积变小,这时Ke () ,x(CO2)-|||-() ,Kx () 。-|||-选择填入:(a)变大;(b)变小;(c)不变;(d)不确定。

题目解答
答案
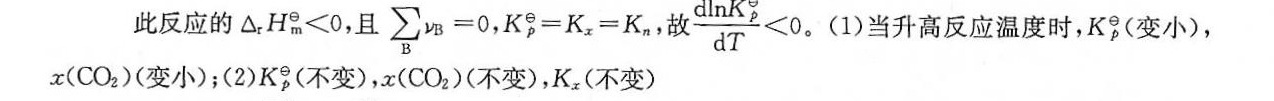
解析
步骤 1:分析反应的热力学性质
反应 $C{H}_{4}(g)+2{O}_{2}(g)=\!=\!= C{O}_{2}(g)+2{H}_{2}O(g)$ 是一个放热反应,即 ${\Delta }_{r}{H}_{m}^{\theta }\lt 0$。这意味着反应物的总能量高于生成物的总能量,反应过程中会释放热量。
步骤 2:恒压下温度对标准平衡常数的影响
在恒压条件下,升高反应体系的温度,由于反应是放热的,根据勒夏特列原理,平衡会向吸热方向移动,即向左移动,以抵消温度升高的影响。因此,标准平衡常数Kg会变小,同时CO2的摩尔分数x(CO2)也会变小。
步骤 3:恒温下压力对标准平衡常数的影响
在恒温条件下,增加反应体系的平衡压力,而使体系的体积变小,由于反应物和生成物的气体分子数相等,即反应前后气体分子数不变,因此标准平衡常数Kg不变。同时,由于反应前后气体分子数不变,CO2的摩尔分数x(CO2)也不变。此外,由于反应前后气体分子数不变,Kx也不变。
反应 $C{H}_{4}(g)+2{O}_{2}(g)=\!=\!= C{O}_{2}(g)+2{H}_{2}O(g)$ 是一个放热反应,即 ${\Delta }_{r}{H}_{m}^{\theta }\lt 0$。这意味着反应物的总能量高于生成物的总能量,反应过程中会释放热量。
步骤 2:恒压下温度对标准平衡常数的影响
在恒压条件下,升高反应体系的温度,由于反应是放热的,根据勒夏特列原理,平衡会向吸热方向移动,即向左移动,以抵消温度升高的影响。因此,标准平衡常数Kg会变小,同时CO2的摩尔分数x(CO2)也会变小。
步骤 3:恒温下压力对标准平衡常数的影响
在恒温条件下,增加反应体系的平衡压力,而使体系的体积变小,由于反应物和生成物的气体分子数相等,即反应前后气体分子数不变,因此标准平衡常数Kg不变。同时,由于反应前后气体分子数不变,CO2的摩尔分数x(CO2)也不变。此外,由于反应前后气体分子数不变,Kx也不变。