题目
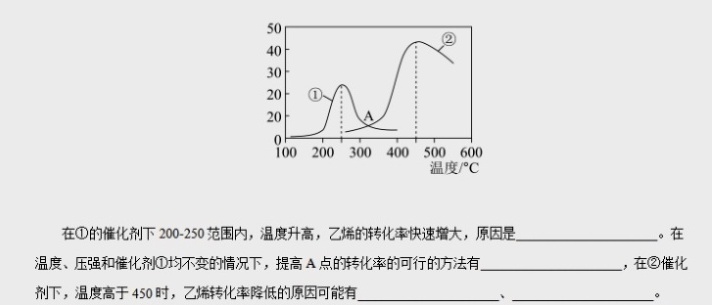
19.(15分)乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。-|||-(1)甲醇制备乙烯的庄要反应:-|||-i (H)_(3)OH(g)=(C)_(2)(H)_(4)(g)+2(H)_(2)O(g) Delta (H)_(1)=-20.9kJ/mol-|||-ii.(H)_(2)OH(g)=(C)_(3)(H)_(6)(g)+3(H)_(2)O(g) Delta (H)_(2)=-98.1kJ/mol-|||-iii (H)_(3)OH(g)=C(H)_(2)(g)+4(H)_(2)O(g) Delta H=-118.1kJcdot mol-|||-C3H6转化为C2H4的热化学方程式iv: (C)_(3)(H)_(6)(g)=3(C)_(2)(H)_(4)(g) Delta (H)_(4)= __ ,该反应能自发进行的条件-|||-是 __ (填"较低""较高"或"任意")温度。-|||-(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用×标注。-|||-C2H2(g)-|||-E=-172kJ/mol-|||-C2H22 E=+66kJ/mol-|||-1/2 H2- →H× C2H2+H-|||-E=-26kJ/mol C2H3^3 E=+85kJ/mol-|||-C 2H4(g)-|||-1/2 H2→H× C2H3^++H-|||-E=-58kJ/mol C2H4^4 E=+82kJ/mol-|||-该历程中最大能垒(活化能) _(2)(E)= __ /mol, 该步骤的化学方程式为 __ _。-|||-(3)Watker法是目前工业上生产乙醛的最重要方法。其反应如下:-|||-(H)_(2)=C(H)_(2)(g)+dfrac (1)(2)(O)_(2)(g)=C(H)_(3)CHO(g) Delta H=-243.68kJ/mol-|||-某温度下,物质的量之比为2:1的 =C(H)_(2) 和O2在刚性容器内发生反应该反应,若起始总压为1.5MPa,-|||-反应达到平衡时总压减少了25%,用各物质的平衡分压表示该反应的平衡常数,则 _(p)= __ ^-0.5 (只-|||-要列出计算式,分压=总压×物质的量分数)。19.(15分)乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。-|||-(1)甲醇制备乙烯的庄要反应:-|||-i (H)_(3)OH(g)=(C)_(2)(H)_(4)(g)+2(H)_(2)O(g) Delta (H)_(1)=-20.9kJ/mol-|||-ii.(H)_(2)OH(g)=(C)_(3)(H)_(6)(g)+3(H)_(2)O(g) Delta (H)_(2)=-98.1kJ/mol-|||-iii (H)_(3)OH(g)=C(H)_(2)(g)+4(H)_(2)O(g) Delta H=-118.1kJcdot mol-|||-C3H6转化为C2H4的热化学方程式iv: (C)_(3)(H)_(6)(g)=3(C)_(2)(H)_(4)(g) Delta (H)_(4)= __ ,该反应能自发进行的条件-|||-是 __ (填"较低""较高"或"任意")温度。-|||-(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用×标注。-|||-C2H2(g)-|||-E=-172kJ/mol-|||-C2H22 E=+66kJ/mol-|||-1/2 H2- →H× C2H2+H-|||-E=-26kJ/mol C2H3^3 E=+85kJ/mol-|||-C 2H4(g)-|||-1/2 H2→H× C2H3^++H-|||-E=-58kJ/mol C2H4^4 E=+82kJ/mol-|||-该历程中最大能垒(活化能) _(2)(E)= __ /mol, 该步骤的化学方程式为 __ _。-|||-(3)Watker法是目前工业上生产乙醛的最重要方法。其反应如下:-|||-(H)_(2)=C(H)_(2)(g)+dfrac (1)(2)(O)_(2)(g)=C(H)_(3)CHO(g) Delta H=-243.68kJ/mol-|||-某温度下,物质的量之比为2:1的 =C(H)_(2) 和O2在刚性容器内发生反应该反应,若起始总压为1.5MPa,-|||-反应达到平衡时总压减少了25%,用各物质的平衡分压表示该反应的平衡常数,则 _(p)= __ ^-0.5 (只-|||-要列出计算式,分压=总压×物质的量分数)。19.(15分)乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。-|||-(1)甲醇制备乙烯的庄要反应:-|||-i (H)_(3)OH(g)=(C)_(2)(H)_(4)(g)+2(H)_(2)O(g) Delta (H)_(1)=-20.9kJ/mol-|||-ii.(H)_(2)OH(g)=(C)_(3)(H)_(6)(g)+3(H)_(2)O(g) Delta (H)_(2)=-98.1kJ/mol-|||-iii (H)_(3)OH(g)=C(H)_(2)(g)+4(H)_(2)O(g) Delta H=-118.1kJcdot mol-|||-C3H6转化为C2H4的热化学方程式iv: (C)_(3)(H)_(6)(g)=3(C)_(2)(H)_(4)(g) Delta (H)_(4)= __ ,该反应能自发进行的条件-|||-是 __ (填"较低""较高"或"任意")温度。-|||-(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用×标注。-|||-C2H2(g)-|||-E=-172kJ/mol-|||-C2H22 E=+66kJ/mol-|||-1/2 H2- →H× C2H2+H-|||-E=-26kJ/mol C2H3^3 E=+85kJ/mol-|||-C 2H4(g)-|||-1/2 H2→H× C2H3^++H-|||-E=-58kJ/mol C2H4^4 E=+82kJ/mol-|||-该历程中最大能垒(活化能) _(2)(E)= __ /mol, 该步骤的化学方程式为 __ _。-|||-(3)Watker法是目前工业上生产乙醛的最重要方法。其反应如下:-|||-(H)_(2)=C(H)_(2)(g)+dfrac (1)(2)(O)_(2)(g)=C(H)_(3)CHO(g) Delta H=-243.68kJ/mol-|||-某温度下,物质的量之比为2:1的 =C(H)_(2) 和O2在刚性容器内发生反应该反应,若起始总压为1.5MPa,-|||-反应达到平衡时总压减少了25%,用各物质的平衡分压表示该反应的平衡常数,则 _(p)= __ ^-0.5 (只-|||-要列出计算式,分压=总压×物质的量分数)。


题目解答
答案

