题目
以NH3-NH4+ 缓冲剂控制锌溶液的pH =10.0,对于EDTA滴定Zn2+的主反应,(1)计算[NH3]=0.10mol•L-1, [CN-]=1.0×10-3mol•L-1时的αZn和 logK’ZnY值。(2)若cY=cZn=0.02000 mol•L-1,求计量点时游离Zn2+的浓度[Zn2+]等于多少?
以NH3-NH4+ 缓冲剂控制锌溶液的pH =10.0,对于EDTA滴定Zn2+的主反应,(1)计算[NH3]=0.10mol•L-1, [CN-]=1.0×10-3mol•L-1时的αZn和 logK’ZnY值。(2)若cY=cZn=0.02000 mol•L-1,求计量点时游离Zn2+的浓度[Zn2+]等于多少?
题目解答
答案
:(1)pH =10.0,查表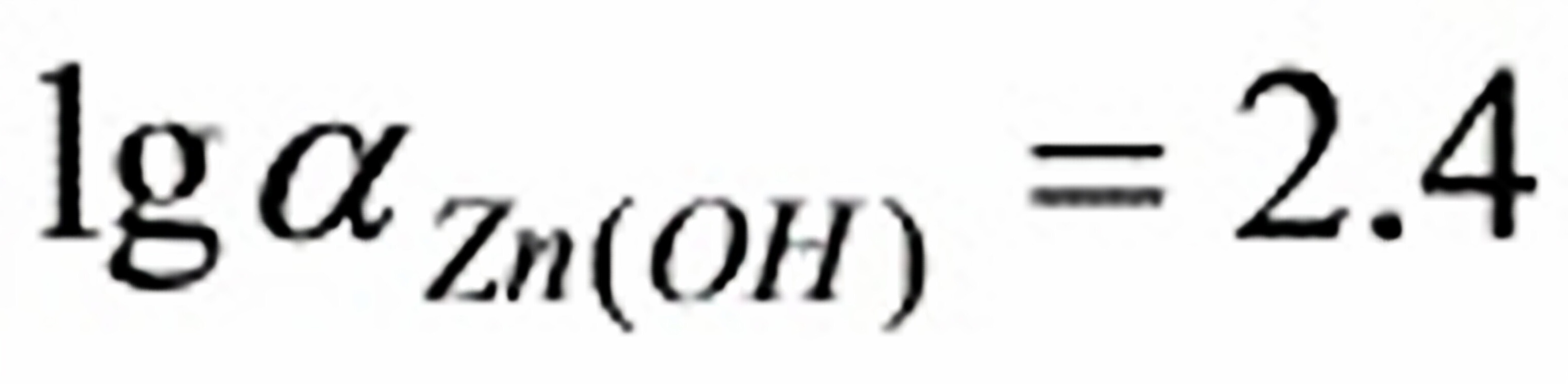 ,Zn2+的NH3络合物的各累积常数为:
,Zn2+的NH3络合物的各累积常数为:
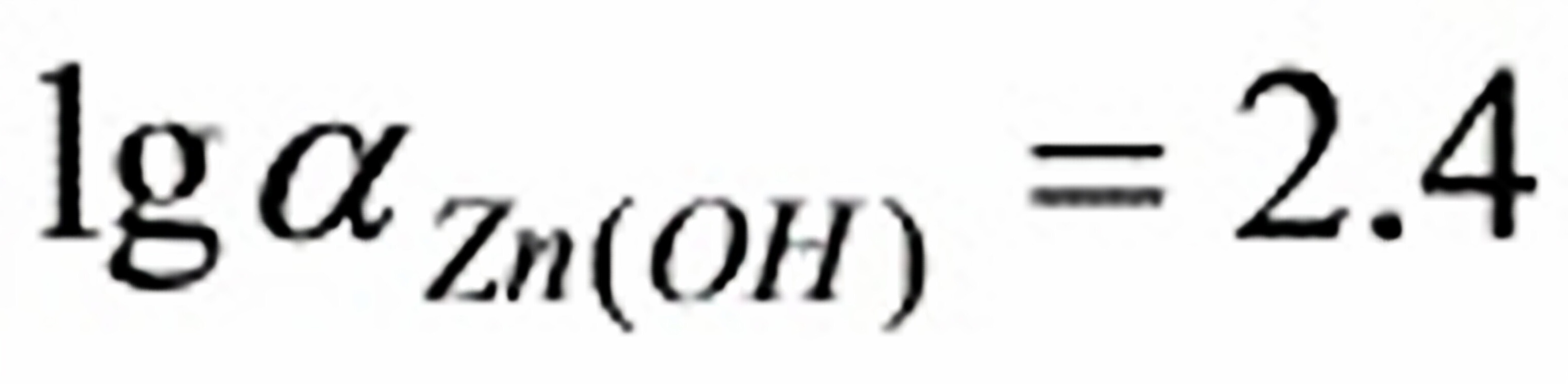 ,Zn2+的NH3络合物的各累积常数为:
,Zn2+的NH3络合物的各累积常数为:lgβ1=2.27; lgβ2=4.61; lgβ3=7.01; lgβ4=9.06
Zn2+的CN-络合物的累积常数为:lgβ4=16.7
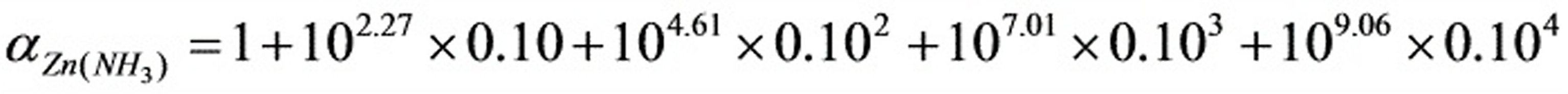
=105.25
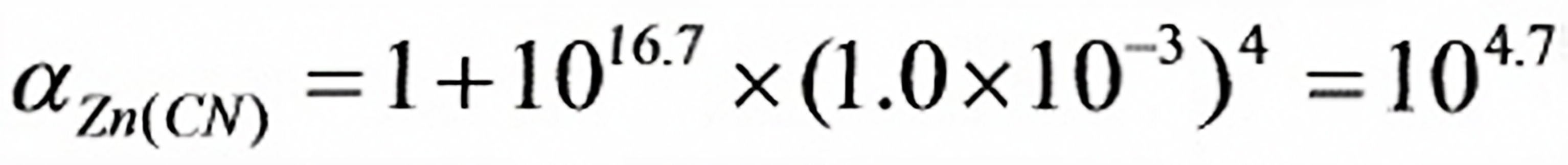
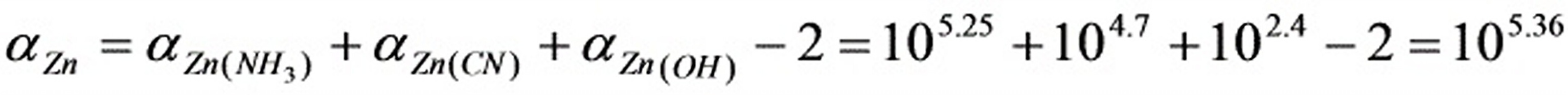
当溶液pH =10.0时,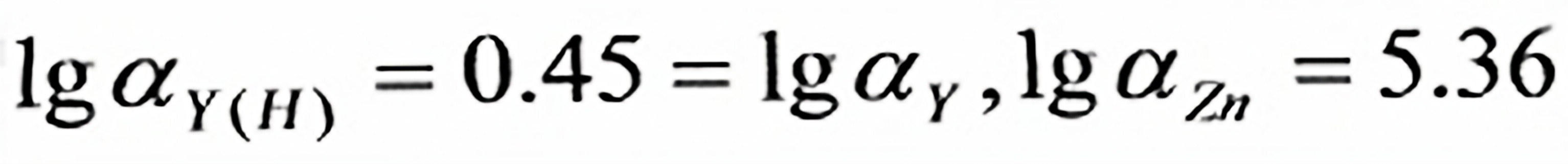 , 故此时
, 故此时
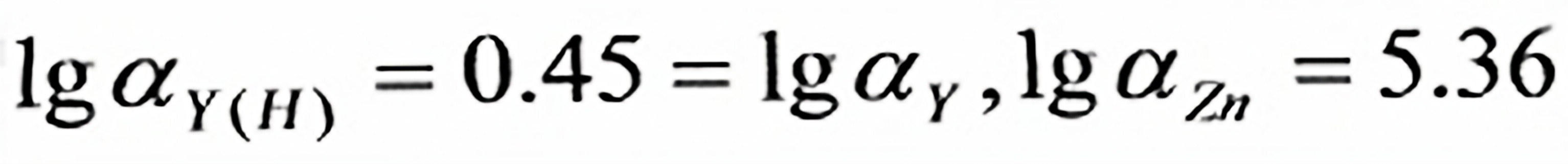 , 故此时
, 故此时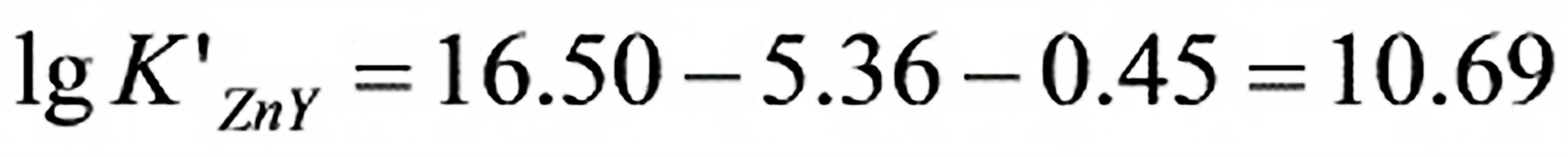
(2)由计量点时cZn , Sp=cZn/2
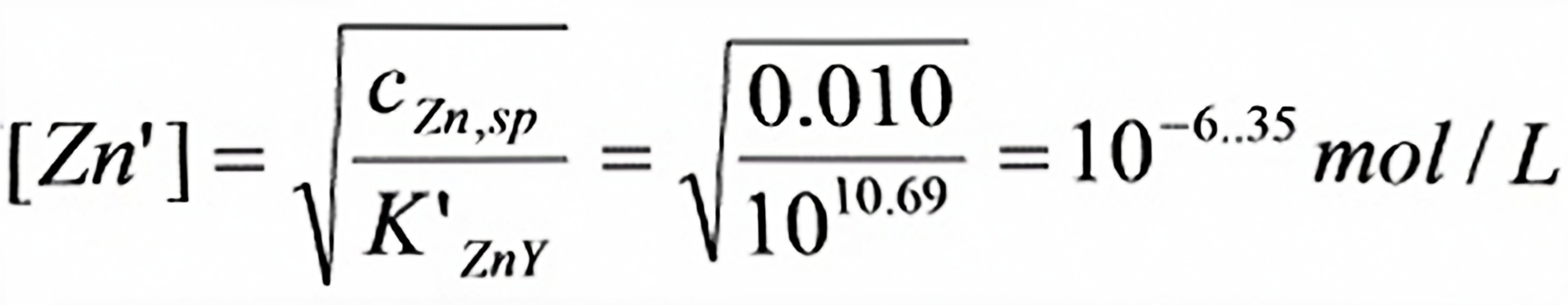
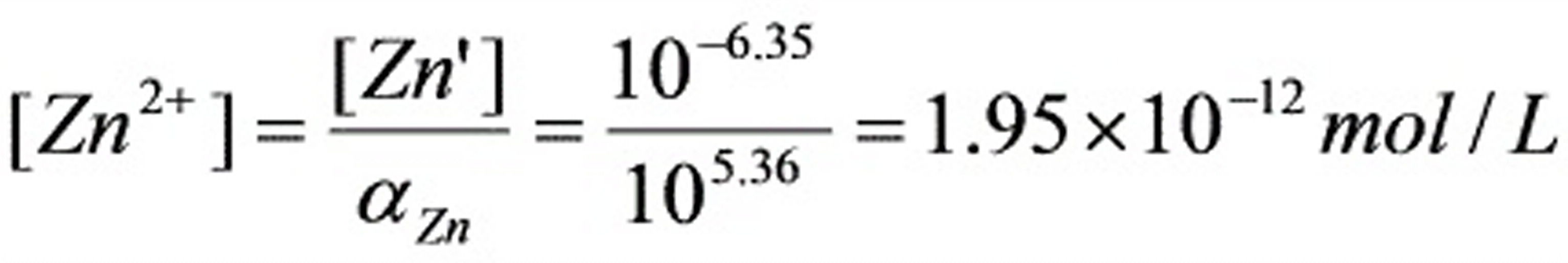
解析
步骤 1:计算αZn
首先,根据题目给出的条件,pH = 10.0,[NH3] = 0.10 mol/L,[CN-] = 1.0×10^-3 mol/L。我们需要计算Zn2+的NH3络合物和CN-络合物的累积常数,然后计算αZn。
步骤 2:计算logK’ZnY
根据计算出的αZn,结合已知的lgKZnY值,计算logK’ZnY。
步骤 3:计算计量点时游离Zn2+的浓度
根据滴定反应的化学计量关系,计算计量点时游离Zn2+的浓度。
首先,根据题目给出的条件,pH = 10.0,[NH3] = 0.10 mol/L,[CN-] = 1.0×10^-3 mol/L。我们需要计算Zn2+的NH3络合物和CN-络合物的累积常数,然后计算αZn。
步骤 2:计算logK’ZnY
根据计算出的αZn,结合已知的lgKZnY值,计算logK’ZnY。
步骤 3:计算计量点时游离Zn2+的浓度
根据滴定反应的化学计量关系,计算计量点时游离Zn2+的浓度。