题目
自救器是人在缺氧环境或出现高浓度有毒有害气体环境中使用的一种安全防护装置。如图是某自救器的示意图,其供氧装置由“初期生氧器”和“生氧罐”组成。同学们对其工作原理进行了如下探究:口具-|||-气体通道 e-|||-引发器-|||-刃期生氧器-|||-制氧剂-|||-.氧罐Ⅰ.探究“初期生氧器”该自救器在工作初期,内部独立的“初期生氧器”首先启动,以解决初期供氧不足的问题。“初期生氧器”内有氯酸钾、二氧化锰、铁粉等成分。(1)“初期生氧器”主要依靠氯酸钾和二氧化锰制氧气,反应的化学方程式为 ____ 。铁粉与氧气反应放热,使氯酸钾的分解能持续进行。Ⅱ.探究“生氧罐”①该自救器主体是由“生氧罐”供氧,内部装有颗粒状超氧化钾作为“制氧剂”,其反应原理为:4KO2+2H2O=4KOH+3O2↑;4KO2+2CO2=2K2CO3+3O2②超氧化钾能与硫酸反应,化学反应方程式为:4KO2+2H2SO4=2K2SO4+3O2↑+2H2O同学们对超氧化钾是否变质展开了研究,取出久置的“生氧罐”内颗粒状固体,称得样品质量为69.3g,进行如图所示实验,待实验结束测得装置C增重2.2g,装置E内固体增重19.2g(实验前已排尽装置内空气,使用的药品均足量)口具-|||-气体通道 e-|||-引发器-|||-刃期生氧器-|||-制氧剂-|||-.氧罐(2)实验过程中E装置内的现象为 ____ 。(3)超氧化钾 ____ (选填“未”“部分”或“全部”)变质。(4)生产该“生氧罐”时加入超氧化钾的质量为 ____ (结果保留到0.1克)。(5)下列有关说法正确的是 ____ 。①反应开始后通入N2的目的是防止液体倒吸②实验过程中装置A内发生了中和反应③为简化实验,装置B可以去掉④实验后储气袋内的气体可回收利用,也可直接排放到空气中
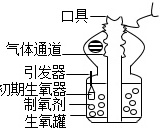
自救器是人在缺氧环境或出现高浓度有毒有害气体环境中使用的一种安全防护装置。如图是某自救器的示意图,其供氧装置由“初期生氧器”和“生氧罐”组成。同学们对其工作原理进行了如下探究:
Ⅰ.探究“初期生氧器”
该自救器在工作初期,内部独立的“初期生氧器”首先启动,以解决初期供氧不足的问题。“初期生氧器”内有氯酸钾、二氧化锰、铁粉等成分。
(1)“初期生氧器”主要依靠氯酸钾和二氧化锰制氧气,反应的化学方程式为 ____ 。铁粉与氧气反应放热,使氯酸钾的分解能持续进行。
Ⅱ.探究“生氧罐”
①该自救器主体是由“生氧罐”供氧,内部装有颗粒状超氧化钾作为“制氧剂”,其反应原理为:4KO2+2H2O=4KOH+3O2↑;4KO2+2CO2=2K2CO3+3O2
②超氧化钾能与硫酸反应,化学反应方程式为:4KO2+2H2SO4=2K2SO4+3O2↑+2H2O
同学们对超氧化钾是否变质展开了研究,取出久置的“生氧罐”内颗粒状固体,称得样品质量为69.3g,进行如图所示实验,待实验结束测得装置C增重2.2g,装置E内固体增重19.2g(实验前已排尽装置内空气,使用的药品均足量)
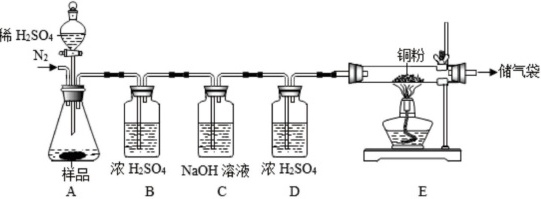
(2)实验过程中E装置内的现象为 ____ 。
(3)超氧化钾 ____ (选填“未”“部分”或“全部”)变质。
(4)生产该“生氧罐”时加入超氧化钾的质量为 ____ (结果保留到0.1克)。
(5)下列有关说法正确的是 ____ 。
①反应开始后通入N2的目的是防止液体倒吸
②实验过程中装置A内发生了中和反应
③为简化实验,装置B可以去掉
④实验后储气袋内的气体可回收利用,也可直接排放到空气中

Ⅰ.探究“初期生氧器”
该自救器在工作初期,内部独立的“初期生氧器”首先启动,以解决初期供氧不足的问题。“初期生氧器”内有氯酸钾、二氧化锰、铁粉等成分。
(1)“初期生氧器”主要依靠氯酸钾和二氧化锰制氧气,反应的化学方程式为 ____ 。铁粉与氧气反应放热,使氯酸钾的分解能持续进行。
Ⅱ.探究“生氧罐”
①该自救器主体是由“生氧罐”供氧,内部装有颗粒状超氧化钾作为“制氧剂”,其反应原理为:4KO2+2H2O=4KOH+3O2↑;4KO2+2CO2=2K2CO3+3O2
②超氧化钾能与硫酸反应,化学反应方程式为:4KO2+2H2SO4=2K2SO4+3O2↑+2H2O
同学们对超氧化钾是否变质展开了研究,取出久置的“生氧罐”内颗粒状固体,称得样品质量为69.3g,进行如图所示实验,待实验结束测得装置C增重2.2g,装置E内固体增重19.2g(实验前已排尽装置内空气,使用的药品均足量)

(2)实验过程中E装置内的现象为 ____ 。
(3)超氧化钾 ____ (选填“未”“部分”或“全部”)变质。
(4)生产该“生氧罐”时加入超氧化钾的质量为 ____ (结果保留到0.1克)。
(5)下列有关说法正确的是 ____ 。
①反应开始后通入N2的目的是防止液体倒吸
②实验过程中装置A内发生了中和反应
③为简化实验,装置B可以去掉
④实验后储气袋内的气体可回收利用,也可直接排放到空气中
题目解答
答案
解:(1)氯酸钾在二氧化锰作催化剂的条件下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)装置E中发生的化学反应是铜和氧气在加热的条件下生成氧化铜,故实验过程中E装置内的现象为红色固体变黑;
(3)因为C装置增重2.2g,说明有2.2g二氧化碳生成,所取样品中含有碳酸钾,E装置内固体变成黑色且增重19.2g,说明有超氧化钾发生反应生成氧气,所以超氧化钾部分变质;
(4)E装置内固体变成黑色且增重19.2g,说明生成氧气19.2g,根据4KO2+2H2SO4=2K2SO4+3O2↑+2H2O和氧气质量求出超氧化钾质量;
设与稀硫酸反应的超氧化钾质量为x,
4KO2+2H2SO4=2K2SO4+3O2↑+2H2O
284 96
x 19.2g
$\frac{284}{96}$=$\frac{x}{19.2g}$
x=56.8g
C装置增重2.2g,说明有2.2g二氧化碳生成,根据4KO2+2H2O=4KOH+3O2↑、K2CO3+H2SO4=K2SO4+H2O+CO2↑,超氧化钾与生成的碳酸钾、二氧化碳的关系为4KO2~2K2CO3~2CO2,
设变质的超氧化钾质量y,碳酸钾的质量为z,
4KO2~2K2CO3~2CO2
284 276 88
y z 2.2g
$\frac{284}{88}$=$\frac{y}{2.2g}$ $\frac{276}{88}$=$\frac{z}{2.2g}$
y=7.1g,z=6.9g
样品质量为69.3g中有氢氧化钾的质量为69.3g-56.8g-6.9g=5.6g,根据4KO2+2H2O=4KOH+3O2↑和氢氧化钾的质量5.6g求出超氧化钾的质量,
设参与此反应的超氧化钾的质量为m,
4KO2+2H2O=4KOH+3O2↑
284 224
m 5.6g
$\frac{284}{224}$=$\frac{m}{5.6g}$
m=7.1g
所以生产该“生氧罐”时加入超氧化钾的质量为56.8g+7.1g+7.1g=71.0g;
(5)①反应开始后通入N2的目的是将产生的二氧化碳和氧气排入后续的反应装置中参与反应,而不是防止液体倒吸,故①说法错误;
②酸与碱作用生成盐和水的反应,叫做中和反应,装置A内超氧化钾与水反应生成的氢氧化钾与稀硫酸反应生成硫酸钾和水,则实验过程中装置A内发生了中和反应的说法正确,故②说法正确;
③装置A产生的气体中含有水蒸气,若去掉装置B,水蒸气会进入装置C,影响实验结果,则为简化实验,去掉装置B的说法错误,故③说法错误;
④实验后储气袋内的气体主要是氧气和氮气,无毒无害,故实验后储气袋内的气体可回收利用,也可直接排放到空气中的说法正确,故④说法正确;
故选:②④。
故答案为:(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)红色固体变黑;
(3)部分;
(4)71.0g;
(5)②④。
(2)装置E中发生的化学反应是铜和氧气在加热的条件下生成氧化铜,故实验过程中E装置内的现象为红色固体变黑;
(3)因为C装置增重2.2g,说明有2.2g二氧化碳生成,所取样品中含有碳酸钾,E装置内固体变成黑色且增重19.2g,说明有超氧化钾发生反应生成氧气,所以超氧化钾部分变质;
(4)E装置内固体变成黑色且增重19.2g,说明生成氧气19.2g,根据4KO2+2H2SO4=2K2SO4+3O2↑+2H2O和氧气质量求出超氧化钾质量;
设与稀硫酸反应的超氧化钾质量为x,
4KO2+2H2SO4=2K2SO4+3O2↑+2H2O
284 96
x 19.2g
$\frac{284}{96}$=$\frac{x}{19.2g}$
x=56.8g
C装置增重2.2g,说明有2.2g二氧化碳生成,根据4KO2+2H2O=4KOH+3O2↑、K2CO3+H2SO4=K2SO4+H2O+CO2↑,超氧化钾与生成的碳酸钾、二氧化碳的关系为4KO2~2K2CO3~2CO2,
设变质的超氧化钾质量y,碳酸钾的质量为z,
4KO2~2K2CO3~2CO2
284 276 88
y z 2.2g
$\frac{284}{88}$=$\frac{y}{2.2g}$ $\frac{276}{88}$=$\frac{z}{2.2g}$
y=7.1g,z=6.9g
样品质量为69.3g中有氢氧化钾的质量为69.3g-56.8g-6.9g=5.6g,根据4KO2+2H2O=4KOH+3O2↑和氢氧化钾的质量5.6g求出超氧化钾的质量,
设参与此反应的超氧化钾的质量为m,
4KO2+2H2O=4KOH+3O2↑
284 224
m 5.6g
$\frac{284}{224}$=$\frac{m}{5.6g}$
m=7.1g
所以生产该“生氧罐”时加入超氧化钾的质量为56.8g+7.1g+7.1g=71.0g;
(5)①反应开始后通入N2的目的是将产生的二氧化碳和氧气排入后续的反应装置中参与反应,而不是防止液体倒吸,故①说法错误;
②酸与碱作用生成盐和水的反应,叫做中和反应,装置A内超氧化钾与水反应生成的氢氧化钾与稀硫酸反应生成硫酸钾和水,则实验过程中装置A内发生了中和反应的说法正确,故②说法正确;
③装置A产生的气体中含有水蒸气,若去掉装置B,水蒸气会进入装置C,影响实验结果,则为简化实验,去掉装置B的说法错误,故③说法错误;
④实验后储气袋内的气体主要是氧气和氮气,无毒无害,故实验后储气袋内的气体可回收利用,也可直接排放到空气中的说法正确,故④说法正确;
故选:②④。
故答案为:(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)红色固体变黑;
(3)部分;
(4)71.0g;
(5)②④。