题目
【题文】研究大气中含硫化合物(主要是SO2和SO2)的转化率具有重要意义。(1)土壤中的微生物可将大气中的SO2经两步反应氧化成SO2,两步反应的能量变化示意图如下:SO2SO2全部氧化成SO2的热化学方程式为___________。(2)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为SO2的密闭容器中充入一定量的SO2和SO2,发生反应:SO2,过程中测定的部分数据见表:时间/SO2SO2SO200.100.05040.0500.02550.040 8 0.020①反应在SO2内的平均速率为SO2___________;②此温度下该反应的化学平衡常数K=___________;③研究表明,SO2催化氧化的反应速率方程为:SO2。式中:k为反应速率常数,随温度t升高而增大;SO2为SO2平衡转化率,SO2为某时刻SO2转化率,n为常数。在SO2时,将一系列温度下的k、SO2值代入上述速率方程,得到v~t曲线如图所示。SO2曲线上v最大值所对应温度称为该SO2下反应的最适宜温度SO2。下列说法正确的是___________。A.v达到最大值时,SO2平衡转化率SO2最大B.温度是影响反应速率的主要因素,温度越高,反应速率越快C.({{t)}_({m)}}" mathml="PG1yb3c+PG10ZXh0PnQ8L210ZXh0Pjxtbz4mZ3Q7PC9tbz48bXN1Yj48bXRleHQ+dDwvbXRleHQ+PG10ZXh0Pm08L210ZXh0PjwvbXN1Yj48L21yb3c+" src="https:/img.zuoyebang.cc/zyb_86f48829115c1694e642bc2d45154e8b.jpg" style="vertical-align:middle;">后,v逐渐下降,原因是升高温度,SO2逐渐降低D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大(3)一般来说,如果一个反应的平衡常数大于SO2,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于SO2,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:SO2,计算反应SO2反应的平衡常数SO2___________。(4)工业上常用SO2与碳酸钠溶液的反应制备焦亚硫酸钠(SO2),SO2可用作食品的抗氧化剂。在测定某葡萄酒中SO2残留量时,取SO2葡萄酒样品,用SO2的碘标准液滴定至终点,消耗碘标准液SO2。滴定反应的离子方程式为___________,该样品中SO2的残留量为___________SO2(以SO2计,保留三位有效数字)。
【题文】研究大气中含硫化合物(主要是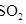 和
和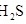 )的转化率具有重要意义。
)的转化率具有重要意义。
(1)土壤中的微生物可将大气中的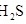 经两步反应氧化成
经两步反应氧化成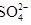 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
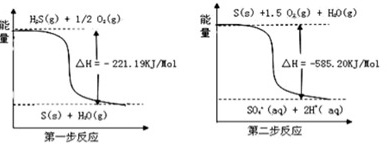
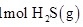 全部氧化成
全部氧化成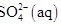 的热化学方程式为
的热化学方程式为___________ 。
(2)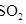 是工业制硫酸的原料气体之一,一定温度下,向容积为
是工业制硫酸的原料气体之一,一定温度下,向容积为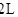 的密闭容器中充入一定量的
的密闭容器中充入一定量的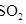 和
和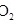 ,发生反应:
,发生反应: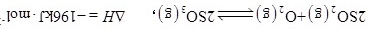 ,过程中测定的部分数据见表:
,过程中测定的部分数据见表:
①反应在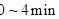 内的平均速率为
内的平均速率为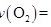
___________ ;
②此温度下该反应的化学平衡常数K=___________ ;
③研究表明,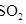 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: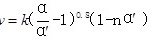 。式中:k为反应速率常数,随温度t升高而增大;
。式中:k为反应速率常数,随温度t升高而增大; 为
为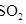 平衡转化率,
平衡转化率,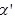 为某时刻
为某时刻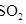 转化率,n为常数。在
转化率,n为常数。在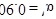 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到v~t曲线如图所示。
值代入上述速率方程,得到v~t曲线如图所示。
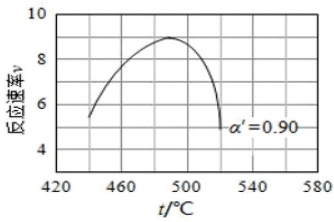
曲线上v最大值所对应温度称为该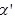 下反应的最适宜温度
下反应的最适宜温度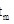 。下列说法正确的是
。下列说法正确的是___________ 。
A.v达到最大值时,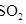 平衡转化率
平衡转化率 最大
最大
B.温度是影响反应速率的主要因素,温度越高,反应速率越快
C.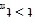 后,v逐渐下降,原因是升高温度,
后,v逐渐下降,原因是升高温度, 逐渐降低
逐渐降低
D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大
(3)一般来说,如果一个反应的平衡常数大于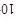 ,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于
,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于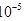 ,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
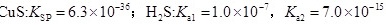 ,
,
计算反应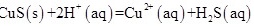 反应的平衡常数
反应的平衡常数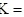
___________ 。
(4)工业上常用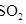 与碳酸钠溶液的反应制备焦亚硫酸钠(
与碳酸钠溶液的反应制备焦亚硫酸钠(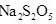 ),
),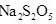 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中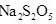 残留量时,取
残留量时,取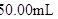 葡萄酒样品,用
葡萄酒样品,用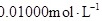 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液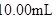 。滴定反应的离子方程式为
。滴定反应的离子方程式为___________ ,该样品中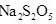 的残留量为
的残留量为___________ 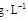 (以
(以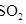 计,保留三位有效数字)。
计,保留三位有效数字)。
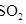 和
和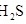 )的转化率具有重要意义。
)的转化率具有重要意义。(1)土壤中的微生物可将大气中的
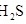 经两步反应氧化成
经两步反应氧化成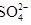 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
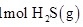 全部氧化成
全部氧化成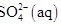 的热化学方程式为
的热化学方程式为(2)
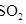 是工业制硫酸的原料气体之一,一定温度下,向容积为
是工业制硫酸的原料气体之一,一定温度下,向容积为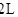 的密闭容器中充入一定量的
的密闭容器中充入一定量的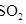 和
和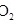 ,发生反应:
,发生反应: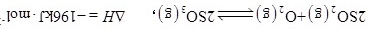 ,过程中测定的部分数据见表:
,过程中测定的部分数据见表:时间/ | 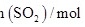 | 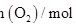 |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | | 0.020 |
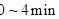 内的平均速率为
内的平均速率为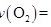
②此温度下该反应的化学平衡常数K=
③研究表明,
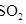 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: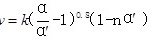 。式中:k为反应速率常数,随温度t升高而增大;
。式中:k为反应速率常数,随温度t升高而增大; 为
为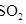 平衡转化率,
平衡转化率,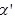 为某时刻
为某时刻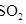 转化率,n为常数。在
转化率,n为常数。在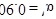 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到v~t曲线如图所示。
值代入上述速率方程,得到v~t曲线如图所示。
曲线上v最大值所对应温度称为该
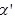 下反应的最适宜温度
下反应的最适宜温度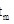 。下列说法正确的是
。下列说法正确的是A.v达到最大值时,
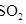 平衡转化率
平衡转化率 最大
最大B.温度是影响反应速率的主要因素,温度越高,反应速率越快
C.
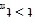 后,v逐渐下降,原因是升高温度,
后,v逐渐下降,原因是升高温度, 逐渐降低
逐渐降低D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大
(3)一般来说,如果一个反应的平衡常数大于
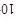 ,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于
,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于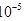 ,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数: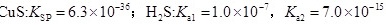 ,
,计算反应
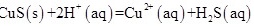 反应的平衡常数
反应的平衡常数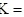
(4)工业上常用
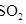 与碳酸钠溶液的反应制备焦亚硫酸钠(
与碳酸钠溶液的反应制备焦亚硫酸钠(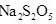 ),
),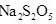 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中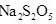 残留量时,取
残留量时,取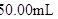 葡萄酒样品,用
葡萄酒样品,用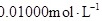 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液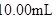 。滴定反应的离子方程式为
。滴定反应的离子方程式为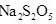 的残留量为
的残留量为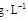 (以
(以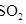 计,保留三位有效数字)。
计,保留三位有效数字)。题目解答
答案
【答案】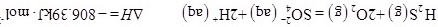
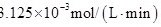 225 CD
225 CD 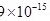
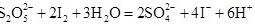 0.128
0.128
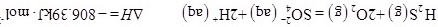
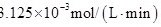 225 CD
225 CD 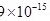
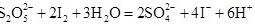 0.128
0.128