题目
A 浓硫酸-|||-a-|||-B-|||-铜片-|||-NaHCO3 KMnO4 Na2SiO3-|||-酸性-|||-C 饱和溶液 溶液 溶液-|||-D E F某研究性学习小组设计了一组实验验证元素周期律。Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。(1)甲同学设计实验的目的:验证同一主族,从上到下金属元素原子失电子能力逐渐增强;同一周期主族元素从左到右金属元素原子失电子能力逐渐 ____ 。(2)烧杯中反应最剧烈的金属是 ____ (填字母)。A.钠B.镁C.铝D.钾(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法 ____ (填字母)。A.把镁、铝的金属块换成金属粉末B.把烧杯中的冷水换成热水C.把烧杯中的冷水换成等量的同浓度的盐酸D.把烧杯中的冷水换成氢氧化钠溶液Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。(4)实验装置:仪器B的名称为 ____ 。(5)实验步骤:连接仪器、 ____ 、加药品,打开a,然后滴入浓硫酸,加热。(6)问题探究:(已知酸性亚硫酸>碳酸)①铜与浓硫酸反应的化学方程式是 ____ ;装置E中酸性KMnO4溶液的作用是 ____ 。②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是 ____ ;试管F中发生反应的离子方程式为 ____ 。③依据试管D中的反应,能否证明S的非金属性强于C的非金属性? ____ (填“能”或“否”)。说明理由 ____ 。
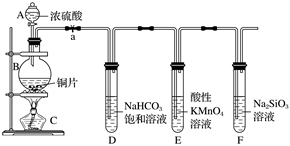 某研究性学习小组设计了一组实验验证元素周期律。
某研究性学习小组设计了一组实验验证元素周期律。Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的:验证同一主族,从上到下金属元素原子失电子能力逐渐增强;同一周期主族元素从左到右金属元素原子失电子能力逐渐 ____ 。
(2)烧杯中反应最剧烈的金属是 ____ (填字母)。
A.钠
B.镁
C.铝
D.钾
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法 ____ (填字母)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成等量的同浓度的盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。
(4)实验装置:仪器B的名称为 ____ 。
(5)实验步骤:连接仪器、 ____ 、加药品,打开a,然后滴入浓硫酸,加热。
(6)问题探究:(已知酸性亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 ____ ;装置E中酸性KMnO4溶液的作用是 ____ 。
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是 ____ ;试管F中发生反应的离子方程式为 ____ 。
③依据试管D中的反应,能否证明S的非金属性强于C的非金属性? ____ (填“能”或“否”)。说明理由 ____ 。
题目解答
答案
(1)减弱
(2)D
(3)BC
(4)圆底烧瓶
(5)检查装置的气密性
(6)Cu+2H2SO4(浓) $\begin{array}{l}{\underline{\underline Δ}}\\{}\end{array}$CuSO4+SO2↑+2H2O 吸收SO2 E试管中的溶液褪色不完全,F试管中出现白色沉淀 CO2+H2O+$SiO_3^{2-}$=H2SiO3↓+$CO_3^{2-}$或2CO2+2H2O+$SiO_3^{2-}$=H2SiO3↓+2$HCO_3^-$否 H2SO3不是S元素最高价氧化物对应的水化物
【分析】一般通过金属与水的反应速率或则金属与酸反应的速率来验证金属性的强弱,而验证非金属性强弱,一般通过非金属的最高价氧化物对应水化物的酸性强弱来验证。
【详解】(1)同一周期主族元素从左到右金属性减弱,即金属元素原子失电子能力逐渐减弱;故答案为:减弱。
(2)根据同周期从左到右金属性逐渐减弱,同主族从上到下金属性逐渐增强,因此金属性最强的是左下角的元素,因此烧杯中反应最剧烈的金属是钾;故答案为:D。
(3)A.把镁、铝的金属块换成金属粉末,反应速率依然不明显,故A不符合题意;B.把烧杯中的冷水换成热水,镁与热水反应,产生气泡,铝与热水缓慢气泡,能达到实验目的,故B符合题意;C.把烧杯中的冷水换成等量的同浓度的盐酸,镁与盐酸产生大量气泡,铝与盐酸产生气泡,根据气泡的快慢来比较速率,故C符合题意;D.把烧杯中的冷水换成氢氧化钠溶液,镁与氢氧化钠溶液不反应,不能比较,故D不符合题意;综上所述,答案为:BC。
(4)根据图中信息得到仪器B的名称为圆底烧瓶;故答案为:圆底烧瓶。
(5)实验步骤:连接仪器、检查装置气密性、加药品,打开a,然后滴入浓硫酸,加热;故答案为:检查装置的气密性。
(6)①铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,其反应的化学方程式是Cu+2H2SO4(浓) $\begin{array}{l}{\underline{\underline Δ}}\\{}\end{array}$CuSO4+SO2↑+2H2O;装置D中出来的气体是二氧化碳和二氧化硫的混合气体,要验证二氧化碳和硅酸钠反应,因此要先除掉二氧化硫,则装置E中酸性KMnO4溶液的作用是吸收SO2;故答案为:Cu+2H2SO4(浓) $\begin{array}{l}{\underline{\underline Δ}}\\{}\end{array}$CuSO4+SO2↑+2H2O;吸收SO2。
②要根据二氧化碳中是否有二氧化硫,若二氧化碳中没有二氧化硫,则根据二氧化碳和硅酸钠反应生成硅酸沉淀来说明碳元素的非金属性比硅元素的非金属性强的实验现象是E试管中的溶液褪色不完全,F试管中出现白色沉淀;试管F中发生反应的离子方程式为CO2+H2O+$SiO_3^{2-}$=H2SiO3↓+$CO_3^{2-}$或2CO2+2H2O+$SiO_3^{2-}$=H2SiO3↓+2$HCO_3^-$;故答案为:E试管中的溶液褪色不完全,F试管中出现白色沉淀;CO2+H2O+$SiO_3^{2-}$=H2SiO3↓+$CO_3^{2-}$或2CO2+2H2O+$SiO_3^{2-}$=H2SiO3↓+2$HCO_3^-$。
③依据试管D中的反应,不能证明S的非金属性强于C的非金属性,验证非金属性强弱一般从非金属性最高价氧化物对应水化物的酸,利用强弱制弱酸来验证,而该实验用的是亚硫酸,而不是S元素最高价氧化物对应的水化物;故答案为;否;H2SO3不是S元素最高价氧化物对应的水化物。
(2)D
(3)BC
(4)圆底烧瓶
(5)检查装置的气密性
(6)Cu+2H2SO4(浓) $\begin{array}{l}{\underline{\underline Δ}}\\{}\end{array}$CuSO4+SO2↑+2H2O 吸收SO2 E试管中的溶液褪色不完全,F试管中出现白色沉淀 CO2+H2O+$SiO_3^{2-}$=H2SiO3↓+$CO_3^{2-}$或2CO2+2H2O+$SiO_3^{2-}$=H2SiO3↓+2$HCO_3^-$否 H2SO3不是S元素最高价氧化物对应的水化物
【分析】一般通过金属与水的反应速率或则金属与酸反应的速率来验证金属性的强弱,而验证非金属性强弱,一般通过非金属的最高价氧化物对应水化物的酸性强弱来验证。
【详解】(1)同一周期主族元素从左到右金属性减弱,即金属元素原子失电子能力逐渐减弱;故答案为:减弱。
(2)根据同周期从左到右金属性逐渐减弱,同主族从上到下金属性逐渐增强,因此金属性最强的是左下角的元素,因此烧杯中反应最剧烈的金属是钾;故答案为:D。
(3)A.把镁、铝的金属块换成金属粉末,反应速率依然不明显,故A不符合题意;B.把烧杯中的冷水换成热水,镁与热水反应,产生气泡,铝与热水缓慢气泡,能达到实验目的,故B符合题意;C.把烧杯中的冷水换成等量的同浓度的盐酸,镁与盐酸产生大量气泡,铝与盐酸产生气泡,根据气泡的快慢来比较速率,故C符合题意;D.把烧杯中的冷水换成氢氧化钠溶液,镁与氢氧化钠溶液不反应,不能比较,故D不符合题意;综上所述,答案为:BC。
(4)根据图中信息得到仪器B的名称为圆底烧瓶;故答案为:圆底烧瓶。
(5)实验步骤:连接仪器、检查装置气密性、加药品,打开a,然后滴入浓硫酸,加热;故答案为:检查装置的气密性。
(6)①铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,其反应的化学方程式是Cu+2H2SO4(浓) $\begin{array}{l}{\underline{\underline Δ}}\\{}\end{array}$CuSO4+SO2↑+2H2O;装置D中出来的气体是二氧化碳和二氧化硫的混合气体,要验证二氧化碳和硅酸钠反应,因此要先除掉二氧化硫,则装置E中酸性KMnO4溶液的作用是吸收SO2;故答案为:Cu+2H2SO4(浓) $\begin{array}{l}{\underline{\underline Δ}}\\{}\end{array}$CuSO4+SO2↑+2H2O;吸收SO2。
②要根据二氧化碳中是否有二氧化硫,若二氧化碳中没有二氧化硫,则根据二氧化碳和硅酸钠反应生成硅酸沉淀来说明碳元素的非金属性比硅元素的非金属性强的实验现象是E试管中的溶液褪色不完全,F试管中出现白色沉淀;试管F中发生反应的离子方程式为CO2+H2O+$SiO_3^{2-}$=H2SiO3↓+$CO_3^{2-}$或2CO2+2H2O+$SiO_3^{2-}$=H2SiO3↓+2$HCO_3^-$;故答案为:E试管中的溶液褪色不完全,F试管中出现白色沉淀;CO2+H2O+$SiO_3^{2-}$=H2SiO3↓+$CO_3^{2-}$或2CO2+2H2O+$SiO_3^{2-}$=H2SiO3↓+2$HCO_3^-$。
③依据试管D中的反应,不能证明S的非金属性强于C的非金属性,验证非金属性强弱一般从非金属性最高价氧化物对应水化物的酸,利用强弱制弱酸来验证,而该实验用的是亚硫酸,而不是S元素最高价氧化物对应的水化物;故答案为;否;H2SO3不是S元素最高价氧化物对应的水化物。