题目
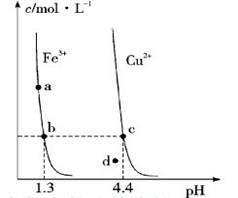
【题文】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是:( )c/mol·L^(-1)-|||-Fe^(3+) ^2+-|||-a-|||-b c-|||-d·-|||-1.3 4.4 pH A.c/mol·L^(-1)-|||-Fe^(3+) ^2+-|||-a-|||-b c-|||-d·-|||-1.3 4.4 pH B.加适量NH4Cl固体可使溶液由a点变到b点 C.c/mol·L^(-1)-|||-Fe^(3+) ^2+-|||-a-|||-b c-|||-d·-|||-1.3 4.4 pH、d两点代表的溶液中c(H+)与c(OH—)乘积相等 D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的 溶液中达到饱和
【题文】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是:( )
溶液中达到饱和

A.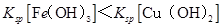 |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
C. 、d两点代表的溶液中c(H+)与c(OH—)乘积相等 、d两点代表的溶液中c(H+)与c(OH—)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的 |
题目解答
答案
【答案】B
解析
步骤 1:分析选项A
根据图中金属阳离子浓度随pH的变化,可以判断Fe(OH)_3和Cu(OH)_2的溶度积常数大小。Fe^(3+)的浓度在pH=4.4时开始下降,而Cu^(2+)的浓度在pH=1.3时开始下降,说明Fe(OH)_3的溶解度比Cu(OH)_2小,因此${K}_{sp}[ Fe{(OH)}_{3}] < {K}_{sp}[ Cu{(OH)}_{2}]$。
步骤 2:分析选项B
加适量NH_4Cl固体,NH_4^+水解产生H^+,使溶液pH降低,而图中a点到b点是pH升高的过程,因此加适量NH_4Cl固体不能使溶液由a点变到b点。
步骤 3:分析选项C
d两点代表的溶液中c(H^{+})与c(OH^{—})乘积相等,因为它们都在同一条pH线上,而pH是溶液中H^+浓度的负对数,所以c(H^{+})与c(OH^{—})乘积相等。
步骤 4:分析选项D
Fe(OH)_3、Cu(OH)_2分别在b、c两点代表的溶液中达到饱和,因为b、c两点分别是Fe^(3+)和Cu^(2+)浓度开始下降的点,说明此时Fe(OH)_3和Cu(OH)_2的溶解度达到最大,即达到饱和。
根据图中金属阳离子浓度随pH的变化,可以判断Fe(OH)_3和Cu(OH)_2的溶度积常数大小。Fe^(3+)的浓度在pH=4.4时开始下降,而Cu^(2+)的浓度在pH=1.3时开始下降,说明Fe(OH)_3的溶解度比Cu(OH)_2小,因此${K}_{sp}[ Fe{(OH)}_{3}] < {K}_{sp}[ Cu{(OH)}_{2}]$。
步骤 2:分析选项B
加适量NH_4Cl固体,NH_4^+水解产生H^+,使溶液pH降低,而图中a点到b点是pH升高的过程,因此加适量NH_4Cl固体不能使溶液由a点变到b点。
步骤 3:分析选项C
d两点代表的溶液中c(H^{+})与c(OH^{—})乘积相等,因为它们都在同一条pH线上,而pH是溶液中H^+浓度的负对数,所以c(H^{+})与c(OH^{—})乘积相等。
步骤 4:分析选项D
Fe(OH)_3、Cu(OH)_2分别在b、c两点代表的溶液中达到饱和,因为b、c两点分别是Fe^(3+)和Cu^(2+)浓度开始下降的点,说明此时Fe(OH)_3和Cu(OH)_2的溶解度达到最大,即达到饱和。