题目
绪论[0-1]1m3水中溶解0.05kmol CO2,试求溶液中CO2的摩尔分数,水的密度为100kg/m3。解水/(m)^3=dfrac (1000)(18)kmo(l)^3CO2的摩尔分数/(m)^3=dfrac (1000)(18)kmo(l)^3[0-2]在压力为101325、温度为25℃条件下,甲醇在空气中达到饱和状态。试求:(1)甲醇的饱和蒸气压;(2)空气中甲醇的组成,以摩尔分数、质量分数、浓度、质量浓度表示。
绪论
[0-1]1m3水中溶解0.05kmol CO2,试求溶液中CO2的摩尔分数,水的密度为100kg/m3。
解水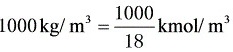
CO2的摩尔分数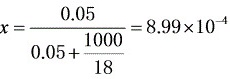
[0-2]在压力为101325、温度为25℃条件下,甲醇在空气中达到饱和状态。试求:(1)甲醇的饱和蒸气压;(2)空气中甲醇的组成,以摩尔分数、质量分数、浓度、质量浓度表示。
题目解答
答案
解 (1)甲醇的饱和蒸气压
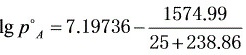
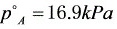
(2) 空气中甲醇的组成
摩尔分数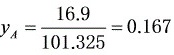
质量分数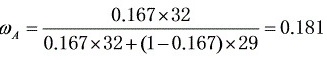
浓度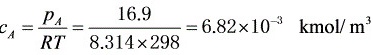
质量浓度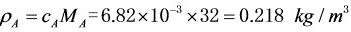
[0-3]1000kg的电解液中含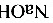 质量分数10%、
质量分数10%、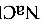 的质量分数10%、
的质量分数10%、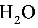 的质量分数80%,用真空蒸发器浓缩,食盐结晶分离后的浓缩液中含
的质量分数80%,用真空蒸发器浓缩,食盐结晶分离后的浓缩液中含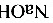 50%、
50%、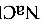 2%、
2%、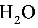 48%,均为质量分数。试求:(1)水分蒸发量;(2)分离的食盐量;(3)食盐分离后的浓缩液量。在全过程中,溶液中的
48%,均为质量分数。试求:(1)水分蒸发量;(2)分离的食盐量;(3)食盐分离后的浓缩液量。在全过程中,溶液中的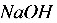 量保持一定。
量保持一定。
解电解液1000kg浓缩液中
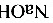 1000×0.l=100kg
1000×0.l=100kg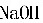 =0.5(质量分数)
=0.5(质量分数)
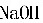 1000×0.l=100kg
1000×0.l=100kg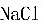 =0.02(质量分数)
=0.02(质量分数)
1000×0.8=800kg=0.48(质量分数)
在全过程中,溶液中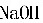 量保持一定,为100kg
量保持一定,为100kg
浓缩液量为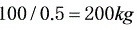
200kg浓缩液中,水的含量为200×0.48=96kg,故水的蒸发量为800-96=704kg
浓缩液中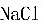 的含量为200×0.02=4kg,故分离的
的含量为200×0.02=4kg,故分离的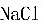 量为100-4=96kg
量为100-4=96kg
解析
步骤 1:计算甲醇的饱和蒸气压
根据题目给出的条件,甲醇在25℃下的饱和蒸气压可以通过查表或公式计算得到。这里直接给出结果。
步骤 2:计算空气中甲醇的摩尔分数
根据理想气体定律,甲醇的饱和蒸气压与空气中甲醇的摩尔分数成正比。
步骤 3:计算空气中甲醇的质量分数
根据甲醇和空气的摩尔质量,可以将摩尔分数转换为质量分数。
步骤 4:计算空气中甲醇的浓度
根据甲醇的饱和蒸气压和理想气体定律,可以计算出甲醇的浓度。
步骤 5:计算空气中甲醇的质量浓度
根据甲醇的浓度和摩尔质量,可以计算出甲醇的质量浓度。
根据题目给出的条件,甲醇在25℃下的饱和蒸气压可以通过查表或公式计算得到。这里直接给出结果。
步骤 2:计算空气中甲醇的摩尔分数
根据理想气体定律,甲醇的饱和蒸气压与空气中甲醇的摩尔分数成正比。
步骤 3:计算空气中甲醇的质量分数
根据甲醇和空气的摩尔质量,可以将摩尔分数转换为质量分数。
步骤 4:计算空气中甲醇的浓度
根据甲醇的饱和蒸气压和理想气体定律,可以计算出甲醇的浓度。
步骤 5:计算空气中甲醇的质量浓度
根据甲醇的浓度和摩尔质量,可以计算出甲醇的质量浓度。