简答题3401、什么叫分子轨道?按量子力学基本原理做了哪些近似以后才有分子轨道的概念? 这些近似的根据是什么?3402、试述由原子轨道有效地形成分子轨道的条件。3403、现有4s,4px,4py,4pz,3,3 d,3dxy,3dxz,3dyz等九个原子轨道,若规定z轴为键轴方向,则它们之间(包括自身间)可能组成哪些分子轨道?各是何种分子轨道?3404、以 z 轴为键轴,下列"原子轨道对"之间能否形成分子轨道?若能,写出是什么轨道,若不能, 画"×" 。原子轨道对 分子轨道pz─dxypx─dxzd─d─px─px3405、写出N2分子的基态价电子组态及其键级,说明原因。3406、写出N2基态时的价层电子组态,并解N2的键长(109.8pm)特别短、键能(942kJ·mol-1)特别大的原因。3407、CF 和 CF+哪一个的键长短些。3408、写出 NF+的价电子组态、键级和磁性。3409、CO 是一个极性较小的分子还是极性较大的分子? 其偶极矩的方向如何?为什么?3410、OH 基的第一电离能是 13.2eV , HF 的第一电离能是 16.05eV ,它们的差值几乎与 O原子和 F原子的 2p 轨道的价轨道电离能之间的差值相同,请用分子轨道理论解释这个结果。3411、试用分子轨道理论讨论 OH 基的结构。(1) 写出 OH 基的电子组态并画出能级图;(2) 什么类型的分子轨道会有未成对电子;(3) 讨论此轨道的性质;(4) 比较 OH 基和 OH-基的最低电子跃迁的能量大小。3412、用分子轨道理论预测 N22-, O22-和 F22-能否稳定存在? 它们的键长与其中性分子相对大小如何?3413、用分子轨道理论预测 N2+, O2+和 F2+能否稳定存在; 它们的键长与其中性分子相对大小如何?3414、用分子轨道理论估计 N2, O2, F2, O22+ 和 F2+等是顺磁分子还是反磁分子。3415、(1) 写出 O2 分子的电子结构, 分析其成键情况,并解释 O2 分子的磁性;(2) 列出 O22-, O2-, O2 和 O2+的键长次序;(3) 有三个振动吸收带:1097 cm-1,1580 cm-1 和 1865 cm-1 ,它们被指定 为是由 O2, O2+ 和 O2-所产生的,指出哪一个谱带是属于O2+的。3416、说明 H2+的键长比 H2 长, 而 O2+的键长比 O2 短的原因。3417、(1) 写出CO的分子轨道表示,计算其键级,指出分子所属点群;(2) 比较CO2,CO和丙酮中C—O键键长顺序,并说明理由;(3) 根据18电子规则,写出下列羰基络合物分子中n的数目,并画出其络合物的立体构型:Cr(CO)n,Fe(CO)n,Ni(CO)n ;(4) 在CO的振动光谱中,观察到2169cm-1强吸收峰,若将CO的简正振动视为谐振子,计算CO的简正振动频率;(5) 在CO的红外光谱中,纯转动谱线间隔为3.86cm-1,计算平衡核间距。3418、在有机化合物中,C═O(羰基)的偶极距很大(=7.67×10-30C·m),而CO分子的偶极距却很小,解释原因。3419、指出下列各分子简正振动中哪些是红外活性的,哪些是非红外活性的:① ② ③ ④H←C→N 3420、请写出下列原子轨道间线性组合成分子轨道的类型(σ,π,δ)及分子轨道对称中心对称行为的分类(g,u)。(1)2px~2px 沿x轴方向(2)d~d 沿z轴方向3421、请按原子单位写出H2+在定核近似条件下的薛定谔方程,并指明能量算符中各项的意义。3422、根据同核双原子分子的电子组态可以预见分子及离子的性质。已知及其离子的键长有如下数据,请画出它们的对应关系。 键长 / pm 121 126 149 112.
简答题
3401、什么叫分子轨道?按量子力学基本原理做了哪些近似以后才有分子轨道的概念? 这些近似的根据是什么?
3402、试述由原子轨道有效地形成分子轨道的条件。
3403、现有4s,4px,4py,4pz,3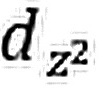 ,3 d
,3 d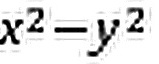 ,3dxy,3dxz,3dyz等九个原子轨道,若规定z轴为键轴方向,则它们之间(包括自身间)可能组成哪些分子轨道?各是何种分子轨道?
,3dxy,3dxz,3dyz等九个原子轨道,若规定z轴为键轴方向,则它们之间(包括自身间)可能组成哪些分子轨道?各是何种分子轨道?
3404、以 z 轴为键轴,下列"原子轨道对"之间能否形成分子轨道?若能,写出是什么轨道,若不能, 画"×" 。
原子轨道对 分子轨道
pz─dxy
px─dxz
d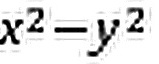 ─d
─d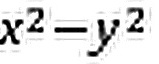
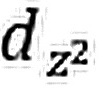 ─
─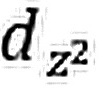
px─px
3405、写出N2分子的基态价电子组态及其键级,说明原因。
3406、写出N2基态时的价层电子组态,并解N2的键长(109.8pm)特别短、键能(942kJ·mol-1)特别大的原因。
3407、CF 和 CF+哪一个的键长短些。
3408、写出 NF+的价电子组态、键级和磁性。
3409、CO 是一个极性较小的分子还是极性较大的分子? 其偶极矩的方向如何?为什么?
3410、OH 基的第一电离能是 13.2eV , HF 的第一电离能是 16.05eV ,它们的差值几乎与 O原子和 F原子的 2p 轨道的价轨道电离能之间的差值相同,请用分子轨道理论解释这个结果。
3411、试用分子轨道理论讨论 OH 基的结构。
(1) 写出 OH 基的电子组态并画出能级图;
(2) 什么类型的分子轨道会有未成对电子;
(3) 讨论此轨道的性质;
(4) 比较 OH 基和 OH-基的最低电子跃迁的能量大小。
3412、用分子轨道理论预测 N22-, O22-和 F22-能否稳定存在? 它们的键长与其中性分子相对大小如何?
3413、用分子轨道理论预测 N2+, O2+和 F2+能否稳定存在; 它们的键长与其中性分子相对大小如何?
3414、用分子轨道理论估计 N2, O2, F2, O22+ 和 F2+等是顺磁分子还是反磁分子。
3415、(1) 写出 O2 分子的电子结构, 分析其成键情况,并解释 O2 分子的磁性;
(2) 列出 O22-, O2-, O2 和 O2+的键长次序;
(3) 有三个振动吸收带:1097 cm-1,1580 cm-1 和 1865 cm-1 ,它们被指定 为是由 O2, O2+ 和 O2-所产生的,指出哪一个谱带是属于O2+的。
3416、说明 H2+的键长比 H2 长, 而 O2+的键长比 O2 短的原因。
3417、(1) 写出CO的分子轨道表示,计算其键级,指出分子所属点群;
(2) 比较CO2,CO和丙酮中C—O键键长顺序,并说明理由;
(3) 根据18电子规则,写出下列羰基络合物分子中n的数目,并画出其络合物的立体构型:Cr(CO)n,Fe(CO)n,Ni(CO)n ;
(4) 在CO的振动光谱中,观察到2169cm-1强吸收峰,若将CO的简正振动视为谐振子,计算CO的简正振动频率;
(5) 在CO的红外光谱中,纯转动谱线间隔为3.86cm-1,计算平衡核间距。
3418、在有机化合物中,C═O(羰基)的偶极距很大(=7.67×10-30C·m),而CO分子的偶极距却很小,解释原因。
3419、指出下列各分子简正振动中哪些是红外活性的,哪些是非红外活性的:
① ②

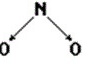 ③ ④H←C→N
③ ④H←C→N
3420、请写出下列原子轨道间线性组合成分子轨道的类型(σ,π,δ)及分子轨道对称中心对称行为的分类(g,u)。
(1)2px~2px 沿x轴方向
(2)d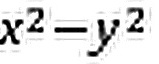 ~d
~d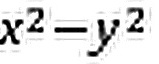 沿z轴方向
沿z轴方向
3421、请按原子单位写出H2+在定核近似条件下的薛定谔方程,并指明能量算符中各项的意义。
3422、根据同核双原子分子的电子组态可以预见分子及离子的性质。已知 及其离子的键长有如下数据,请画出它们的对应关系。
及其离子的键长有如下数据,请画出它们的对应关系。


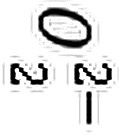
键长 / pm 121 126 149 112
.题目解答
答案
3401、描述分子中单个电子空间运动状态的波函数叫分子轨道。
两个近似 (1) 波恩 - 奥本海默近似 ( 核质量 >> 电子质量 )
(2) 单电子近似 (定态)
3402、(1) 能级高低相近
(2) 对称性匹配
(3) 轨道最大重叠
3403、轨道: s-s, s-pz , s-dz, pz –pz , pz -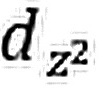 ,
, 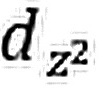 -
-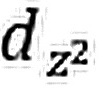 ,
,
轨道px –px ,px –dxz ,py –py ,py –dyz ,dyz –dyz ,dxz –dxz
轨道:dxy-dxy, d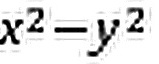 - d
- d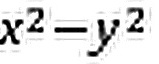
3404、原子轨道对 分子轨道
pz-dxy ×
px-dxz
d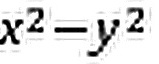 - d
- d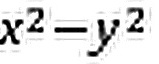
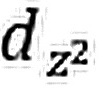 -
-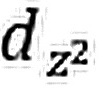
px –px
3405、( 1g)2( 1u)2( 1u)2+2 s-p 混杂显著.
因1u为弱反键,而1g 和1u 均为强成键,故键级在2-3之间.
3406、(1g)2( 1u)2( 1u)4( 2g)2
N2的三重键为 1 个键 (1g)2,2个键 (1u)4,键级为 3
(1u)2和(2g)2分别具有弱反键和弱成键性质, 实际上成为参加成键作用很小的两对孤对电子,可记为 :N≡N: 。因此N2的键长特别短,键能特别大, 是惰性较大的分子。
3407、CF KK-( 1)2(2) 2(3)2 (1)4(2)1
不论 s-p 混杂是否明显, 最高占据的 MO 为(2)1 , 它是反键轨道。故(C-F)+键强些, 短些。
3408、NF+( 1)2(2) 2(3)2 (1)4(2)1
键级 2.5
磁性 顺磁性 ( 有一个不成对电子)
3409、是一个极性较小的分子, 偶极矩方向由氧原子指向碳原子。
3410、OH 的 HOMO 是 1轨道. 这是个非键轨道, 基本上是 O 原子的 2p 轨道.因此, OH 的第一电离能与 O 原子的 2p 轨道的电离能非常接近。
HF 的结构与 OH 类似, 它的 HOMO 是 1 轨道, 也是个非键轨道, 基本上是 F 的 2p 轨道。因此,HF 的第一电离能与 F 原子 2p 轨道的电离能非常接近。
3411、(1) OH 基的电子结构为:( 1)2(2)2(3)2(12py)2(12pz)1
(2) 未成对电子占据轨道
(3) 1 轨道是非键轨道, 仍保持 O 原子的 2p 轨道的特性
(4) OH-的最低的电子跃迁的能量比 OH 基的要高
3412、分 子 N22- O22- F22- N2 O2 F2
电子数 16 18 20 14 16 18
净成键电子数 4 2 0 6 4 2
F22- 净成键电子数为 0 , 不能稳定存在
N22- 和 O22- 能稳定存在
r N22- > rN2
r O22- > rO2
3413、分子 N2+ O2+ F2+ N2 O2 F2
电子数 13 15 17 14 16 18
净成键电子数 5 5 3 6 4 2
r N22- > rN2
r O22- > rO2
r F2+ > r F2
3414、分子 电子数 最高占有分子轨道 磁性
N2 14 ↑↓ 3g 反
O2 16 ↑ ↑ 2g 顺
F2 18 ↑↓ ↑↓ 2g 反
O22+ 14 ↑↓ 3g 反
F2+ 17 ↑↓ ↑ 2g 顺
3415、(1) O2 电子结构为
KK(2s2) (2s*2) (32pz2) (2py2) (2pz2) (2py*1) (2px*1)
顺磁性分子
(2) O22-> O2-> O2 > O2+
(3) 1865 cm-1
3416、3060 H2+ 比 H2 在成键轨道 (1s)上少一个电子, H2+的键级为 0.5, H2 的键级为 1 。
O2+比 O2 在反键轨道 (2p* )上少一个电子, O2+的键级为 2.5; O2 的键级为 2.0 。
3417、(1).KK 12 -22 -14 -32, 3, C∞v
(2).丙酮中最长,CO其次,CO2中的C--O键长最短。因CO2中有2个 34, CO中有-, -,-配键,而丙酮中只-,- 键。
34, CO中有-, -,-配键,而丙酮中只-,- 键。
(3).Cr(CO)6 正八面体
Fe(CO)5 三角双锥
Ni(CO)4 正四面体
(4). =c
=c =6.509×1013s-1
=6.509×1013s-1
2B=h/(42r2)
r =[h/(82B)]1/2
3418、羰基中,C,O之间是+键,由于C,O电负性不同,所以羰基C=0中的极性很大。而一氧化碳中,C,O之间是++键,三重键中一对电子完全由氧原子提供,这就抵消了由于O电负性大而使电荷集中在O端.由于这种配键的存在,CO的极性很小。
3419、①非活性, ②活性, ③非活性, ④活性,
3420、(1)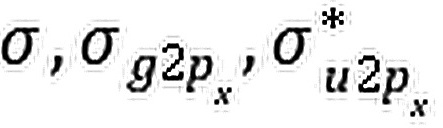
(2)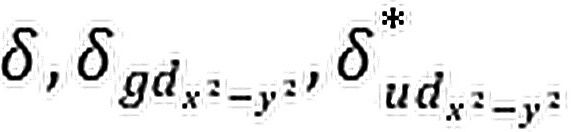
3421、
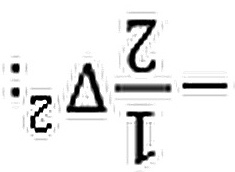 电子的动能算符;
电子的动能算符;
 电子受a原子核的吸引势能算符;
电子受a原子核的吸引势能算符;
 电子受b原子核的吸引势能算符;
电子受b原子核的吸引势能算符;
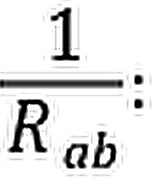 a,
a,
 3422、
3422、 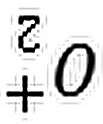



121 126 149 112 (pm)
.