(15分)C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮,Si60、N60以及Si60C60等球形分子被不断制备出来。请回答下列有关问题: (1)电负性是判断元素金属性和非金属性的重要原因之一。电负性相近的原子形成化学键是典型的共价键,且化学性质比较稳定,在溶剂的作用下不易断裂。下列化合物最可能是离子化合物的是(括号中为相应元素的电负性)( ) A.K(0.8)、C60(2.5) B.Si60(1.8)、C60(2.5) C.C3(2.5)、N4(3.0) D.O(3.5)、F2(4.0) (2)电离能不但能说明原子的失电子能力(金属性),也能通过电离能判断元素的化合价,下表列举了C、Mg、X、Y四种元素的电离能(单位:kJ·mol-1),请根据表中数据,回答有关问题: 元素 第一电 离能 第二电 离能 第三电 离能 第四电 离能 第五 电离能 第六 电离能 C 1086.5 2352.6 4620.5 6222.7 37831 47277 Mg 737.7 1450.7 7732.6 10540 13630 17995 X 418.8 3052 4420 5877 7975 9590 Y 538.1 1067 1850 4819 6400 7600 ①若X为第四周期的元素,其核外电子排布为____________。 ②根据Y的电离能数据,可以判断Y最可能的化合价为________。 (3)利用C60独特的分子结构,可以将C60用作比金属及其合金更为有效的新型吸氢材料。现在已知常温下的较稳定的C60的氢化物有C60H24、C60H36和C60H48。这些化合物在80~215 ℃时,C60可以100%的回收,并可以用来重新制备C60的氢化物。请回答:C60分子中碳的杂化类型为________;理论上,1 mol C60可以吸收________mol H2。 (4)已知:①N—N键能为159 kJ·mol-1,N===N键能为456 kJ·mol-1,N≡N键能为946 kJ·mol-1;②N60与C60具有相似的分子结构。请回答: ①N60与C60相比,分子结构相似,但原子的杂化类型不同,N60具有微弱的碱性。则HN60I的晶体类型为________。 ②有科学家预言,N60是一种高能材料,请说明其理论依据________________________________________________________________________。 (5)碳的常见的同素异形体为金刚石和石墨(分子式可表示为Cn),氮化硼也有两种常见的结构,分别对应类似于金刚石和石墨结构【分子式可表示为(BN)n】,下列有关解释正确的是( ) A.C—C键长与B—N键长相等 B.C、B、N的电负性相近 C.(BN)n“分子”中,B、N原子与C原子相似,均能形成四个共价键 D.(BN)n与Cn可以看作是等电子体 (6)美国宾夕法尼亚州立大学中国物理学家郗小星,在世界上首次成功制成大电流硼化镁超导薄膜材料。硼化镁在37 K温度下有超导性,作为超硬超导材料,硼化镁已成为超导材料领域中的一颗新星。图D14-2是硼化镁的晶胞示意图。 。-|||-甲 图D14-2 试推断硼化镁的的化学式为________。 (7)科学界拟合成一种“二重构造”的球形分子(C60Si60),即把“足球型”的C60置于“足球型”的Si60内,并把硅原子与碳原子以共价键结合。合成“二重构造”的球形分子C60Si60的化学反应类似于________(填序号)。 A.由乙烯制氯乙烯 B.乙酸与乙醇制乙酸乙酯 C.乙醇制乙醛 D.乙烯与丙烯合成乙丙树脂
(15分)C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮,Si60、N60以及Si60C60等球形分子被不断制备出来。请回答下列有关问题:
(1)电负性是判断元素金属性和非金属性的重要原因之一。电负性相近的原子形成化学键是典型的共价键,且化学性质比较稳定,在溶剂的作用下不易断裂。下列化合物最可能是离子化合物的是(括号中为相应元素的电负性)( )
A.K(0.8)、C60(2.5) B.Si60(1.8)、C60(2.5)
C.C3(2.5)、N4(3.0) D.O(3.5)、F2(4.0)
(2)电离能不但能说明原子的失电子能力(金属性),也能通过电离能判断元素的化合价,下表列举了C、Mg、X、Y四种元素的电离能(单位:kJ·mol-1),请根据表中数据,回答有关问题:
| 元素 |
第一电 离能 |
第二电 离能 |
第三电 离能 |
第四电 离能 |
第五 电离能 |
第六 电离能 |
| C |
1086.5 |
2352.6 |
4620.5 |
6222.7 |
37831 |
47277 |
| Mg |
737.7 |
1450.7 |
7732.6 |
10540 |
13630 |
17995 |
| X |
418.8 |
3052 |
4420 |
5877 |
7975 |
9590 |
| Y |
538.1 |
1067 |
1850 |
4819 |
6400 |
7600 |
①若X为第四周期的元素,其核外电子排布为____________。
②根据Y的电离能数据,可以判断Y最可能的化合价为________。
(3)利用C60独特的分子结构,可以将C60用作比金属及其合金更为有效的新型吸氢材料。现在已知常温下的较稳定的C60的氢化物有C60H24、C60H36和C60H48。这些化合物在80~215 ℃时,C60可以100%的回收,并可以用来重新制备C60的氢化物。请回答:C60分子中碳的杂化类型为________;理论上,1 mol C60可以吸收________mol H2。
(4)已知:①N—N键能为159 kJ·mol-1,N===N键能为456 kJ·mol-1,N≡N键能为946 kJ·mol-1;②N60与C60具有相似的分子结构。请回答:
①N60与C60相比,分子结构相似,但原子的杂化类型不同,N60具有微弱的碱性。则HN60I的晶体类型为________。
②有科学家预言,N60是一种高能材料,请说明其理论依据________________________________________________________________________。
(5)碳的常见的同素异形体为金刚石和石墨(分子式可表示为Cn),氮化硼也有两种常见的结构,分别对应类似于金刚石和石墨结构【分子式可表示为(BN)n】,下列有关解释正确的是( )
A.C—C键长与B—N键长相等
B.C、B、N的电负性相近
C.(BN)n“分子”中,B、N原子与C原子相似,均能形成四个共价键
D.(BN)n与Cn可以看作是等电子体
(6)美国宾夕法尼亚州立大学中国物理学家郗小星,在世界上首次成功制成大电流硼化镁超导薄膜材料。硼化镁在37 K温度下有超导性,作为超硬超导材料,硼化镁已成为超导材料领域中的一颗新星。图D14-2是硼化镁的晶胞示意图。
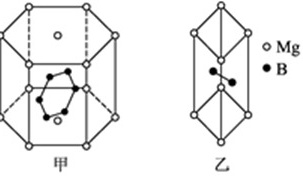
图D14-2
试推断硼化镁的的化学式为________。
(7)科学界拟合成一种“二重构造”的球形分子(C60Si60),即把“足球型”的C60置于“足球型”的Si60内,并把硅原子与碳原子以共价键结合。合成“二重构造”的球形分子C60Si60的化学反应类似于________(填序号)。
A.由乙烯制氯乙烯 B.乙酸与乙醇制乙酸乙酯
C.乙醇制乙醛 D.乙烯与丙烯合成乙丙树脂
题目解答
答案
(1)A (2)①1s22s22p63s23p64s1或【Ar】4s1 ②+3
(3)sp2 30 (4)①离子晶体
②N60形成90个N—N键,分解生成30个N≡N键,每摩尔N60分解放出30 mol×946 kJ/mol-90 mol×159 kJ/mol=14070 kJ的能量,由此可以判断N60为高能材料(或N60分解放出大量的热)
(5)CD (6)MgB2 (7)AD