题目
用0.10 mol∙L-1 NaOH溶液滴定同浓度邻苯二甲酸氢钾(简写成KHB)。计算化学计量点及其前后0.1%的pH. 应选用何种指示剂? (已知H2B的pKa1 = 2.95, pKa2 = 5.41)
用0.10 mol∙L-1 NaOH溶液滴定同浓度邻苯二甲酸氢钾(简写成KHB)。计算化学计量点及其前后0.1%的pH. 应选用何种指示剂? (已知H2B的pKa1 = 2.95, pKa2 = 5.41)
题目解答
答案
解:(1) 化学计量点前0。1%
此时溶液的组成为NaKB-KHB,是缓冲体系,按缓冲溶液的pH值的计算公式有
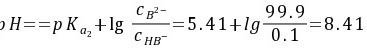
(2) 化学计量点时
此时溶液的组成为NaKB,是二元碱,按一元碱[OH-]的计算公式有
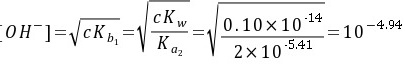 (mol∙L-1)
(mol∙L-1)
pH = 14-4。94 = 9。05可选酚酞为指示剂
(3) 化学计量点后0.1%
此时溶液的组成是NaKB+NaOH,溶液中的pH值由过量的OH- 决定,
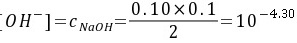 (mol∙L-1)
(mol∙L-1)
pH = 14-4.30 = 9。70
滴定突跃范围pH为8。41~9。70,可选酚酞为指示剂.
2.3.2 配位滴定法
解析
步骤 1:计算化学计量点前0.1%的pH
此时溶液的组成为NaKB-KHB,是缓冲体系。根据缓冲溶液的pH值计算公式,有:
$$
pH = pK_{a2} + \log \frac{[B^{2-}]}{[HB^-]}
$$
其中,$pK_{a2} = 5.41$,$[B^{2-}] = 0.10 \times 0.999 = 0.0999$ mol/L,$[HB^-] = 0.10 \times 0.001 = 0.0001$ mol/L。代入公式计算得:
$$
pH = 5.41 + \log \frac{0.0999}{0.0001} = 5.41 + \log 999 = 5.41 + 2.9996 = 8.41
$$
步骤 2:计算化学计量点时的pH
此时溶液的组成为NaKB,是二元碱。根据一元碱[OH^-]的计算公式,有:
$$
[OH^-] = \sqrt{C \cdot K_{H1}} = \sqrt{\frac{C \cdot K_w}{K_{a2}}} = \sqrt{\frac{0.10 \times 10^{-14}}{10^{-5.41}}} = 10^{-4.94} \text{ mol/L}
$$
其中,$C = 0.10$ mol/L,$K_w = 10^{-14}$,$K_{a2} = 10^{-5.41}$。代入公式计算得:
$$
[OH^-] = 10^{-4.94} \text{ mol/L}
$$
因此,pH = 14 - 4.94 = 9.06。
步骤 3:计算化学计量点后0.1%的pH
此时溶液的组成为NaKB+NaOH,溶液中的pH值由过量的OH^-决定。过量的NaOH浓度为:
$$
[OH^-] = \frac{0.10 \times 0.1}{2} = 10^{-4.30} \text{ mol/L}
$$
因此,pH = 14 - 4.30 = 9.70。
此时溶液的组成为NaKB-KHB,是缓冲体系。根据缓冲溶液的pH值计算公式,有:
$$
pH = pK_{a2} + \log \frac{[B^{2-}]}{[HB^-]}
$$
其中,$pK_{a2} = 5.41$,$[B^{2-}] = 0.10 \times 0.999 = 0.0999$ mol/L,$[HB^-] = 0.10 \times 0.001 = 0.0001$ mol/L。代入公式计算得:
$$
pH = 5.41 + \log \frac{0.0999}{0.0001} = 5.41 + \log 999 = 5.41 + 2.9996 = 8.41
$$
步骤 2:计算化学计量点时的pH
此时溶液的组成为NaKB,是二元碱。根据一元碱[OH^-]的计算公式,有:
$$
[OH^-] = \sqrt{C \cdot K_{H1}} = \sqrt{\frac{C \cdot K_w}{K_{a2}}} = \sqrt{\frac{0.10 \times 10^{-14}}{10^{-5.41}}} = 10^{-4.94} \text{ mol/L}
$$
其中,$C = 0.10$ mol/L,$K_w = 10^{-14}$,$K_{a2} = 10^{-5.41}$。代入公式计算得:
$$
[OH^-] = 10^{-4.94} \text{ mol/L}
$$
因此,pH = 14 - 4.94 = 9.06。
步骤 3:计算化学计量点后0.1%的pH
此时溶液的组成为NaKB+NaOH,溶液中的pH值由过量的OH^-决定。过量的NaOH浓度为:
$$
[OH^-] = \frac{0.10 \times 0.1}{2} = 10^{-4.30} \text{ mol/L}
$$
因此,pH = 14 - 4.30 = 9.70。