题目
P↑-|||-反应物-|||-生成物-|||-反应过程根据所学知识,回答下列问题。Ⅰ.铁片与稀硫酸反应的能量变化特征如图所示:(1)该反应为 ____ 反应(填“吸热”或“放热”)。(2)若要使该反应速率加快,下列措施可行的是 ____ (填正确选项的字母编号)。A.改用铁粉B.改用98%的硫酸C.适当升高温度Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示: 实验编号 水果种类 电极间距离/cm 电流/μA P↑-|||-反应物-|||-生成物-|||-反应过程 1 番茄 1 98.7 2 番茄 2 72.5 3 苹果 2 27.2 (3)该实验目的是研究水果种类和 ____ 对水果电池电流大小的影响。(4)该实验装置中,正极的材料是 ____ ,负极的电极反应式是 ____ 。(5)当有3.25gZn参与反应,转移的电子数目为 ____ 。Ⅲ.某温度下,体积为1L恒容密闭容器中,X、Y两种气体物质的量随时间的变化曲线如图所示。请回答下列问题:P↑-|||-反应物-|||-生成物-|||-反应过程(6)由图中数据分析,该反应的化学方程式为 ____ 。(7)2min时容器内的压强与起始压强之比为 ____ 。(8)在0~2min内,用Y表示的反应速率为 ____ 。(9)不能说明该反应达到平衡状态的是 ____ (填正确选项的字母编号)。A.容器内压强不再变化B.混合气体的密度不再变化C.X气体与Y气体的浓度不再变化D.容器内混合气体平均摩尔质量不再变化
 根据所学知识,回答下列问题。
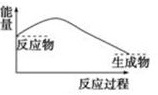
根据所学知识,回答下列问题。Ⅰ.铁片与稀硫酸反应的能量变化特征如图所示:
(1)该反应为 ____ 反应(填“吸热”或“放热”)。
(2)若要使该反应速率加快,下列措施可行的是 ____ (填正确选项的字母编号)。
A.改用铁粉
B.改用98%的硫酸
C.适当升高温度
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流/μA |

|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(4)该实验装置中,正极的材料是 ____ ,负极的电极反应式是 ____ 。
(5)当有3.25gZn参与反应,转移的电子数目为 ____ 。
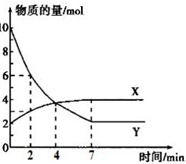
Ⅲ.某温度下,体积为1L恒容密闭容器中,X、Y两种气体物质的量随时间的变化曲线如图所示。请回答下列问题:
(6)由图中数据分析,该反应的化学方程式为 ____ 。
(7)2min时容器内的压强与起始压强之比为 ____ 。
(8)在0~2min内,用Y表示的反应速率为 ____ 。
(9)不能说明该反应达到平衡状态的是 ____ (填正确选项的字母编号)。
A.容器内压强不再变化
B.混合气体的密度不再变化
C.X气体与Y气体的浓度不再变化
D.容器内混合气体平均摩尔质量不再变化
题目解答
答案
解:Ⅰ.(1)该反应反应物的总能量大于生成物的总能量,为放热反应,
故答案为:放热;
(2)A.改用铁粉后接触面积增大,反应速率加快,故A正确;
B.铁和98%的硫酸会钝化,之后反应停止,故B错误;
C.适当升高温度,反应速率加快,故C正确;
故答案为:AC;
Ⅱ.(3)通过图表可以发现,该实验目的是研究水果种类和电极间距离对水果电池电流大小的影响,
故答案为:电极间距离;
(4)该实验装置中,Zn比较活泼,作负极,所以正极的材料是Cu,负极的电极反应式是Zn-2e-=Zn2+,
故答案为:Cu;Zn-2e-=Zn2+;
(5)根据负极的电极反应式可知,1molZn参与反应转移2mol电子,当有3.25gZn即$\frac{3.25g}{65g/mol}$=0.05mol,转移电子数为0.1NA,
故答案为:0.1NA;
Ⅲ.(6)由图可知,Y的物质的量减少,则Y为反应物,而X的物质的量增加,可知X为生成物,Δn(Y):Δn(X)=(10-2)mol:(4-2)mol=4:1,该反应的化学方程式为:4Y⇌X,
故答案为:4Y⇌X;
(7)恒温恒容时,压强之比等于气体物质的量之比,所以2min时容器内的压强与起始压强之比为:n2min:n起始=(3+6):(10+2)=3:4,
故答案为:3:4;
(8)由图可知,0~2min时,Y由10mol减小为6mol,则v(Y)=$\frac{Δc(Y)}{Δt}=\frac{Δn(Y)}{VΔt}$=$\frac{10mol-6mol}{1L×2min}$=2mol⋅L-1⋅min-1,
故答案为:2mol⋅L-1⋅min-1;
(9)A.该反应随着反应的进行压强逐渐减小,当压强不再变化时,该反应达到平衡,故A正确;
B.反应物和产物都是气体且容器为恒容,故密度不是变量,所以混合气体的密度不再变化不能证明该反应达到平衡,故B错误;
C.反应过程中,X气体与Y气体的浓度一直在变化,故当其不再变化时可证明该反应达到平衡,故C正确;
D.该反应随着反应的进行,物质的量逐渐减小,质量不变,因此气体平均摩尔质量是变量,当其不再变化可证明该反应达到平衡,故D正确;
故答案为:B。
故答案为:放热;
(2)A.改用铁粉后接触面积增大,反应速率加快,故A正确;
B.铁和98%的硫酸会钝化,之后反应停止,故B错误;
C.适当升高温度,反应速率加快,故C正确;
故答案为:AC;
Ⅱ.(3)通过图表可以发现,该实验目的是研究水果种类和电极间距离对水果电池电流大小的影响,
故答案为:电极间距离;
(4)该实验装置中,Zn比较活泼,作负极,所以正极的材料是Cu,负极的电极反应式是Zn-2e-=Zn2+,
故答案为:Cu;Zn-2e-=Zn2+;
(5)根据负极的电极反应式可知,1molZn参与反应转移2mol电子,当有3.25gZn即$\frac{3.25g}{65g/mol}$=0.05mol,转移电子数为0.1NA,
故答案为:0.1NA;
Ⅲ.(6)由图可知,Y的物质的量减少,则Y为反应物,而X的物质的量增加,可知X为生成物,Δn(Y):Δn(X)=(10-2)mol:(4-2)mol=4:1,该反应的化学方程式为:4Y⇌X,
故答案为:4Y⇌X;
(7)恒温恒容时,压强之比等于气体物质的量之比,所以2min时容器内的压强与起始压强之比为:n2min:n起始=(3+6):(10+2)=3:4,
故答案为:3:4;
(8)由图可知,0~2min时,Y由10mol减小为6mol,则v(Y)=$\frac{Δc(Y)}{Δt}=\frac{Δn(Y)}{VΔt}$=$\frac{10mol-6mol}{1L×2min}$=2mol⋅L-1⋅min-1,
故答案为:2mol⋅L-1⋅min-1;
(9)A.该反应随着反应的进行压强逐渐减小,当压强不再变化时,该反应达到平衡,故A正确;
B.反应物和产物都是气体且容器为恒容,故密度不是变量,所以混合气体的密度不再变化不能证明该反应达到平衡,故B错误;
C.反应过程中,X气体与Y气体的浓度一直在变化,故当其不再变化时可证明该反应达到平衡,故C正确;
D.该反应随着反应的进行,物质的量逐渐减小,质量不变,因此气体平均摩尔质量是变量,当其不再变化可证明该反应达到平衡,故D正确;
故答案为:B。